
A、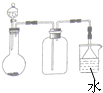 |
B、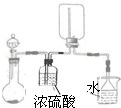 |
C、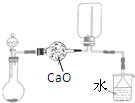 |
D、 |
| ||
| ||


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、金属钠在空气中燃烧,生成氧化钠 |
| B、钠是密度比水小的金属单质,能浮在水面上 |
| C、钠是银白色、质软、熔点相对较低 |
| D、将金属钠放在石棉网上用酒精灯加热后,金属钠剧烈燃烧,产生黄色火焰. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、需要加热的反应说明它是吸热反应 |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表中元素排序的依据是元素的相对原子质量 |
| B、第IA金属比第IIA金属元素的金属性强 |
| C、元素周期表有十六个纵行,也就是十六个族 |
| D、元素周期表中元素排序的依据是原子的核电荷数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期\主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
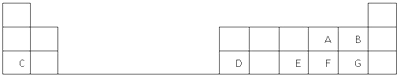
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com