
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| C. | 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32- | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
分析 A.白色沉淀可能为碳酸钡;
B.产生使湿润红色石蕊试纸变蓝气体,气体为氨气;
C.无色气体,可能为二氧化碳或二氧化硫;
D.白色沉淀为硫酸钡或AgCl.
解答 解:A.白色沉淀可能为碳酸钡,则溶液中可能含Ca2+或Ba2+等,故A错误;
B.产生使湿润红色石蕊试纸变蓝气体,气体为氨气,则原溶液中存在NH4+,故B正确;
C.无色气体,可能为二氧化碳或二氧化硫,则溶液中含有CO32-或SO32-,或HCO3-等,故C错误;
D.白色沉淀为硫酸钡或AgCl,则原溶液中可能含Ag+或SO42-,但二者不能同时存在,故D错误;
故选B.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的方法、试剂、现象与结论为解答关键,侧重分析与应用能力的考查,注意离子检验时排除干扰离子,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
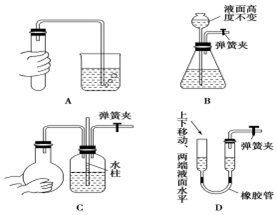
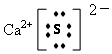 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,再移走酒精灯停止加热 | |
| B. | 蒸馏实验中,温度计的水银球应插入液态混合物中 | |
| C. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| D. | 蒸馏时,蒸馏时冷凝水从冷凝管下口进上口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 用小苏打治疗胃酸(盐酸)过多:HCO3-+H+═CO2↑+H2O | |
| D. | CaCO3溶于稀硝酸中:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
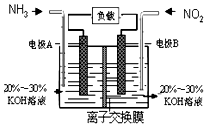 空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2中有少量HCl气体(氢氧化钠溶液) | B. | CO中混有CO2(石灰水、浓硫酸) | ||
| C. | CO2中有少量CO(灼热氧化铜) | D. | Cl2中混有HCl(饱和食盐水、浓硫酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
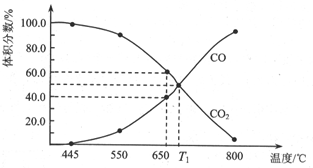 一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.
一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
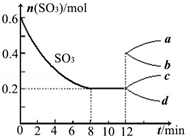 在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com