
����ʹ�������Դ����չ����̼���á�����Ϊ��ѧ���о�����Ҫ���⡣�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�ء�
��1������ˮ����ת������H2����Ҫת����Ӧ���£�
CH4(g) + H2O(g) CO(g) + 3H2(g) ��H=+206��2 kJ��mol��1
CO(g) + 3H2(g) ��H=+206��2 kJ��mol��1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) ��H=+165��0 kJ��mol��1
CO2(g) + 4H2(g) ��H=+165��0 kJ��mol��1
������Ӧ����ԭ�����е�CO��ʹ�ϳɰ��Ĵ����ж��������ȥ����ҵ�ϳ����ô���������CO��ˮ������Ӧ�����׳�ȥ��CO2��ͬʱ���Ƶõ�����������ķ������˷�Ӧ��Ϊһ����̼�任��Ӧ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��2�������״���ԭ��CO��H2��Դ�ڣ�CH4(g) + H2O(g)  CO(g) + 3H2(g) ��H>0
CO(g) + 3H2(g) ��H>0
��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼa����A��B��C���㴦��Ӧƽ�ⳣ����KA��KB��KC���Ĵ�С��ϵΪ___________��(�<������>������="��" )��
��100��ʱ����1 mol CH4��2 mol H2Oͨ���ݻ�Ϊ1 L�Ķ����ܷ������У�������Ӧ����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����__________
a�������������ܶȺ㶨
b����λʱ��������0��1 mol CH4ͬʱ����0��3 mol H2
c��������ѹǿ�㶨
d��3v��(CH4) = v��(H2)
��3��25��ʱ����20mL0��1mol/L������м���VmL0��1mol/LNaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����_____��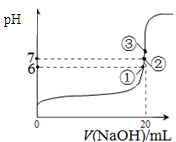
A��pH��3��HF��Һ��pH��11��NaF��Һ�У� ��ˮ�������c(H+)���
B���ٵ�ʱpH��6����ʱ��Һ�У�c(F��)��c(Na+)��9��9��10-7mol/L
C���ڵ�ʱ����Һ�е�c(F��)��c(Na+)
D���۵�ʱV��20mL����ʱ��Һ��c(Na+)��0��1mol/L
��4������������һֱ��Ϊ���ĺ�������ڡ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO����ṹʽΪH��O��F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��1�� CO(g) + H2O(g) CO2(g) + H2(g) ��H=��41��2 kJ��mol��1 ��2�֣�
CO2(g) + H2(g) ��H=��41��2 kJ��mol��1 ��2�֣�
��2���� KC = KB >KA ��2�֣�
�� cd ��2�֣�
��3��BC ��2�֣�
��4��H2O��HFO=HF��H2O2 ��2�֣�
���������������1�� �ȶ���֪�Ȼ�ѧ����ʽ���Ϊ�٢ڣ��۲췢�֢�-�ٿɵã�CO(g) + H2O(g) CO2(g) + H2(g) ��H=��41��2 kJ��mol��1��
CO2(g) + H2(g) ��H=��41��2 kJ��mol��1��
��2���� ƽ�ⳣ��ָ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ����ѧƽ�ⳣ��ֻ���¶��йأ�����B��C��������ͬ���¶ȣ�����KC = KB��Ȼ��A��B������ȣ���A��B�������ת���ʱ��˵���������ƶ�����ѧƽ�ⳣ���������KB>KA �����Դ���KC = KB >KA��
�� ��������������ֲ��䣬���������غ㶨��֪����Ӧǰ����������������䣬����������������ܶȲ��䣬���Բ��ܱ����ﵽ��ѧƽ��״̬����a����λʱ��������0��1 mol CH4ͬʱ����0��3 mol H2��������v�������Բ��ܱ����ﵽ��ѧƽ��״̬����b�����淴Ӧ���л�����������ʵ������������ݻ����䣬ѹǿ����������ѹǿ�㶨ʱ��˵������ƽ�⣬��c��ȷ��3v��(CH4) = v��(H2)�����ʵ���������֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ����ƽ�⣬��d��ȷ������ѡcd��
��3��pH��3��HF��Һ����ˮ�������c(H+)�� ��10-11mol��L��1��pH��11��NaF��Һ�У���ˮ�������c(H+)��10-14/10-11��10-3mol��L��1��A�����ٵ�ʱ�����ݵ����غ㣬c(OH��)��c(F��)��c(Na+)��c(H��)��c(F��)��c(Na+)��c(H��)��c(OH��)��10-6��
��10-11mol��L��1��pH��11��NaF��Һ�У���ˮ�������c(H+)��10-14/10-11��10-3mol��L��1��A�����ٵ�ʱ�����ݵ����غ㣬c(OH��)��c(F��)��c(Na+)��c(H��)��c(F��)��c(Na+)��c(H��)��c(OH��)��10-6�� ��9��9��10-7mol/L��B�ԣ����ݵ����غ㣬c(OH��)��c(F��)��c(Na+)��c(H��)���ڵ�ʱpH=7����Һ�е�c(H��)��c(OH��)������c(F��)��c(Na+)��C�ԣ��۵�ʱV��20mL����ʱ��Һ��c(Na+)��
��9��9��10-7mol/L��B�ԣ����ݵ����غ㣬c(OH��)��c(F��)��c(Na+)��c(H��)���ڵ�ʱpH=7����Һ�е�c(H��)��c(OH��)������c(F��)��c(Na+)��C�ԣ��۵�ʱV��20mL����ʱ��Һ��c(Na+)�� ��0��05mol/L������ѡBC��
��0��05mol/L������ѡBC��
��4���縺��F��O����H-O-F��FԪ�ر���-1�ۣ���ˮ��Ӧ����HF������ˮ�ⷴӦ������֪AΪH-O-O-H���÷�Ӧ�Ļ�ѧ����ʽΪ��H2O+HFO=HF+H2O2��
���㣺�����Ȼ�ѧ����ʽ����ѧƽ��ͼ��Ӱ�����ء�ƽ�ⳣ����ƽ��״̬�жϡ�������ʵĵ��롢����Ũ�ȱȽϵȡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
X��Y��Z��W��Ϊ10���ӵķ��ӻ����ӡ�X��5��ԭ�Ӻˡ�ͨ��״���£�WΪ��ɫҺ�塣����֮��ת����ϵ��ͼ��ʾ����ش�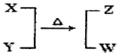
��1����ҵ��ÿ��ȡ1molZҪ�ų�46.2 kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��2����ҵ��ȡZ�Ļ�ѧƽ�ⳣ��K��T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 | ���� |
| K/(mol��L��1)��2 | 4.1��106 | K1 | K2 | ���� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����̼ѭ������������ĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ����ԡ���̼���á�����Ϊ��ѧ���о�����Ҫ���⡣
��1��д��CO2��H2��Ӧ����CH4��H2O���Ȼ�ѧ����ʽ ��
��֪�� �� CO(g)+H2O(g) H2(g)+CO2(g) ��H����41kJ��mol��1
H2(g)+CO2(g) ��H����41kJ��mol��1
�� C(s)+2H2(g) CH4(g) ��H����73kJ��mol��1
CH4(g) ��H����73kJ��mol��1
�� 2CO(g) C(s)+CO2(g) ��H����171kJ��mol��1
C(s)+CO2(g) ��H����171kJ��mol��1
��2����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)����֪һ�������£��÷�Ӧ��CO2��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO2)]�ı仯����������ͼ��
CH3OCH3(g) + 3H2O(g)����֪һ�������£��÷�Ӧ��CO2��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO2)]�ı仯����������ͼ��
����������������ʱ��������ͼ�л���ƽ��ʱCH3OCH3�����������Ͷ�ϱ�[n(H2) / n(CO2)]�仯������ͼ��
��ij�¶��£���2.0molCO2(g)��6.0molH2(g)�����ݻ�Ϊ2L���ܱ������У���Ӧ����ƽ��ʱ���ı�ѹǿ���¶ȣ�ƽ����ϵ��CH3OCH3(g)�����ʵ��������仯�����ͼ��ʾ�������¶Ⱥ�ѹǿ�Ĺ�ϵ�ж���ȷ���� ��
A. P3��P2��T3��T2 B. P1��P3��T1��T3 C. P2��P4��T4��T2 D. P1��P4��T2��T3
���ں����ܱ������ﰴ�����Ϊ1:3���������̼���� ����һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ�����淴Ӧ�����ƶ����� ��
A. ����Ӧ������������С
B. �淴Ӧ������������С
C. ��ѧƽ�ⳣ��Kֵ����
D. ��Ӧ�������ٷֺ�������
E. ���������ܶȼ�С
F. ������ת���ʼ�С
��3�������ѧ���ٴ��������ɫ��ѧ�����룺�ѿ�������̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ�����е�CO2ת��Ϊ������ȼ�ϼ״����״�������ȼ�ϵ�أ�д����ϡ����Ϊ����ʼ״�ȼ�ϵ�ظ�����Ӧʽ__ ���Դ�ȼ�ϵ����Ϊ��ӵ�Դ��ͼ��ʾ�������ͭ��Һ�������ʼʱʢ��1000mL pH��5������ͭ��Һ��25�棬CuSO4��������һ��ʱ�����Һ��pH��Ϊ1����ʱ�ɹ۲쵽�������� ����Ҫʹ��Һ�ָ�����ʼŨ�ȣ��¶Ȳ��䣬������Һ����ı仯����������Һ�м��� �����������ƣ���������ԼΪ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ݻ�ѧѧ���еĻ������ۣ���ش��������⣺
�����£�ȡpH��2������ʹ�����Һ��100 ml, �����зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ���_____ (�A����B��)��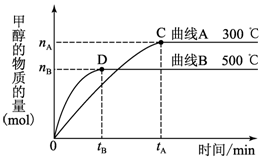
������ȼ��ʱ�ܷų��������ȣ���Ҳ��Һ��ʯ��������Ҫ�ɷ֣���Ϊ��ԴӦ�������ǵ��ճ����������
��֪����2C3H8��g��+7O2��g����6CO��g��+8H2O��l������H1����2741.8kJ/mol
��2CO��g��+O2��g����2CO2��g�� ��H2����566kJ/mol
��1��д�������ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
��2������1mol C3H8�ڲ�������������ȼ�գ�����1mol CO��2mol CO2�Լ���̬ˮ�������еIJ���ͨ��һ���̶����Ϊ1L���ܱ������У���һ�������·������¿��淴Ӧ��
CO��g��+H2O��g����CO2��g��+ H2��g�� ��H1��+41.2kJ/mol
��������ʵ��˵���÷�Ӧ�ﵽƽ�����
a����ϵ�е�ѹǿ�������仯 b��v��(H2)��v��(CO)
c����������ƽ����Է��������������仯 d��CO2��Ũ�Ȳ��ٷ����仯
��5min����ϵ�ﵽƽ�⣬���ⶨ��H2Ϊ0.8mol����v(H2)= ��
����ƽ����ϵ�г�������CO����ƽ�ⳣ�� �����������С�����䡱����
��3�����ݣ�1���еķ�Ӧ�������һ������ȼ�ϵ�أ�һ��ͨ���������һ��ͨ��������壻ȼ�ϵ���ڲ������ڵIJ����������ƣ�Y2O3��������ﯣ�ZrO2�����壬�����ڲ����Դ���O2-���ڵ���ڲ�O2-���� �������������������ص������缫��ӦΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)��֪��
��Fe(s)��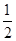 O2(g)=FeO(s)����H����272.0 kJ��mol��1
O2(g)=FeO(s)����H����272.0 kJ��mol��1
��2Al(s)�� O2(g)=Al2O3(s)����H����1675.7 kJ��mol��1
O2(g)=Al2O3(s)����H����1675.7 kJ��mol��1
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��____________________________________
(2)ij���淴Ӧ�ڲ�ͬ�����µķ�Ӧ���̷ֱ�ΪA��B(����ͼ��ʾ)��
�ٸ���ͼ�жϸ÷�Ӧ�ﵽƽ��������������䣬�����¶ȣ���Ӧ���ת����________(�������С�����䡱)��
������B���̱����˷�Ӧ���õ�����Ϊ________(ѡ�����)��
A�������¶ȡ������� B������Ӧ���Ũ�� C�������¶� D��ʹ�ô���
(3)1000 ��ʱ���������������������з�Ӧ��Na2SO4(s)��4H2(g) Na2S(s)��4H2O(g)
Na2S(s)��4H2O(g)
�÷�Ӧ��ƽ�ⳣ������ʽΪ________________________________��
��֪K1000 ��<K1200 ������������ϵ�¶ȣ���������ƽ����Է�����������________(�������С�����䡱)��
(4)�����£����ȡ0.1 mol��L��1 HA��Һ��0.1 mol��L��1 NaOH��Һ��������(��Ϻ���Һ����ı仯���Բ���)����û��Һ��pH��8��
�ٻ��Һ����ˮ�������OH��Ũ����0.1 mol��L��1 NaOH��Һ����ˮ�������OH��Ũ��֮��Ϊ________��
����֪NH4A��ҺΪ���ԣ���֪��HA��Һ�ӵ�Na2CO3��Һ��������ų������ƶ�(NH4)2CO3��Һ��pH________7(�<����>������)����ͬ�¶��£������ʵ���Ũ�ȵ�������������Һ��pH�ɴ�С������˳��Ϊ(�����)________��
a��NH4HCO3 b��NH4A c��(NH4)2CO3 d��NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ú��������úΪԭ��,������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
(1)��֪��25 �桢101 kPaʱ,C(s)��H2(g)��CO(g)ȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ:
C(s)+O2(g) CO2(g)����H1="-393.5" kJ/mol;
CO2(g)����H1="-393.5" kJ/mol;
H2(g)+ O2(g)
O2(g) H2O(g)����H2="-241.8" kJ/mol;
H2O(g)����H2="-241.8" kJ/mol;
CO(g)+ O2(g)
O2(g) CO2(g)����H3="-283.0" kJ/mol;
CO2(g)����H3="-283.0" kJ/mol;
����C(s)+H2O(g) CO(g)+H2(g)����H=��������,�÷�Ӧƽ�ⳣ���ı���ʽΪK=��������������������;�����¶�,��Kֵ��������(��������С�����䡱)��
CO(g)+H2(g)����H=��������,�÷�Ӧƽ�ⳣ���ı���ʽΪK=��������������������;�����¶�,��Kֵ��������(��������С�����䡱)��
������ٷ�Ӧ���ݻ�������ܱ������н���,����Ӧ�ﵽƽ��ʱ��������(����)��
a.v��(CO)��v��(H2)=1��1
b.̼���������ֲ���
c.v��(CO)=v��(H2O)
d.�����е�ѹǿ����
�����ݻ�������ܱ������н��Тٷ�Ӧ,����ʹc(CO)�����������������
a.�����¶�
b.����He(g),ʹ��ϵѹǿ����
c.��H2(g)����ϵ�з������
d.�������
(2)����ͬ����CO(g)��H2O(g)�ֱ�ͨ�����Ϊ2 L�ĺ����ܱ�������,���з�ӦCO(g)+H2O(g) CO2(g)+H2(g),�õ�����2������:
CO2(g)+H2(g),�õ�����2������:
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���� ��ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�µġ���������������������2016��1��1�����ҹ�ȫ��ʵʩ���ݴˣ�������������ָ��(AQI)�ձ���ʵʱ���������SO2��NO2��CO��O3��PM10��PM2.5��ָ�꣬Ϊ�����ṩ����ָ�����������ؾ���������ų��к����
(1)�����ų���β���к���CO��NO�����壬�û�ѧ����ʽ���Ͳ���NO��ԭ��________________________________________
(2)�����������ڰ�װ�Ĵ�ת��������ʹ����β���е���Ҫ��Ⱦ��ת��Ϊ���Ĵ���ѭ�����ʡ���֪��
N2(g)��O2(g)===2NO(g)����H����180.5 kJ��mol��1
2C(s)��O2(g)===2CO(g)����H����221.0 kJ��mol��1
C(s)��O2(g)===CO2(g)����H����393.5 kJ��mol��1
��Ӧ2NO(g)��2CO(g)??N2(g)��2CO2(g)�Ħ�H��________kJ��mol��1���÷�Ӧ�Ħ�S________0(�>����<������)��
(3)��0.20 mol NO��0.10 mol CO����һ���ݻ��㶨Ϊ1 L���ܱ������У��ڲ�ͬ�����·�Ӧ�����в������ʵ�Ũ�ȱ仯״����ͼ��ʾ��
�ټ������N2��6��9 minʱ��ƽ����Ӧ����v(N2)��________mol��L��1��min��1��
�ڵ�12 minʱ�ı�ķ�Ӧ����Ϊ________(����¡����¡�)��
�ۼ��㷴Ӧ�ڵ�24 minʱ��ƽ�ⳣ��K��________���������¶Ȳ��䣬���������г���CO��N2��0.060 mol��ƽ�⽫________�ƶ�(�����������)��
(4)��������л����ó������ⶨ�����к��нϸ�Ũ��SO2�ĺ����������һЩ������20 ����������±���
| �ܽ��(S)/g | �ܶȻ�(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaSO3 | BaSO3 |
| 0.160 | 3.89 | 6.76��10��3 | 5.48��10��9 |
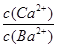 ��____________(д������ʽ����)��
��____________(д������ʽ����)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ȼ�����һ����Ҫ�Ļ���ԭ�ϣ���ˮ�Ȼ�������ʪ����������ˮ����FeCl3��nH2O��
��1��ʵ����������װ�ã����ּ��ȡ��гֵ�װ������ȥ���Ʊ���ˮ�Ȼ������塣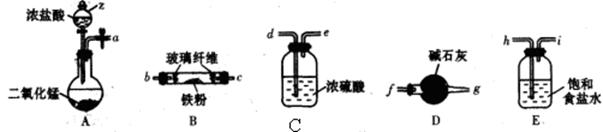
��װ��A������z��������___________��
�ڼ�������װ��A�����ԵIJ�����______________________��
�۰������������Ӹ������ӿڣ�˳��Ϊa��_________ ��__________ ��_________ ��__________��b��c��_________��__________��װ��D��������______________________��
��2����ҵ���Ʊ���ˮ�Ȼ�����һ�ֹ����������£�
���������з�����Ӧ�����ӷ���ʽΪ_________________________________________��
�ڼ�����FeCl3��6H2O����õ���ˮ�Ȼ����IJ�����________________________________��
���õ������ⶨ������ˮ�Ȼ�����������������ȡm����ˮ�Ȼ�����Ʒ������ϡ���ᣬ��ת�Ƶ�100 mL����ƿ�У�������ˮ���ݣ�ȡ��10 mL�������Թ�����KI��Һ����ַ�Ӧ����ָʾ��_________�����Լ����ƣ�����c mol/L��Na2S2O3��Һ���еζ����յ�ʱ����V mLNa2S2O3��Һ����֪��I2��2S2O32����2I����S4O62����������Ʒ���Ȼ�������������Ϊ____________��
��3������֪��
Fe(OH)3(aq) Fe3��(aq)��3OH��(aq) ��H��a kJ/mol
Fe3��(aq)��3OH��(aq) ��H��a kJ/mol
H2O(l) H��(aq)��OH��(aq) ��H��b kJ/mol
H��(aq)��OH��(aq) ��H��b kJ/mol
��д��Fe3������ˮ�ⷴӦ���Ȼ�ѧ����ʽ________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ҹ��Ǹ��������,��������Ϊ�����һ,��¯��������Ϊ�ձ������������
I.��֪��Ӧ 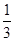 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
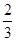 Fe(s)+ CO2(g) ��H��-23.5 kJ��mol-1���÷�Ӧ��
Fe(s)+ CO2(g) ��H��-23.5 kJ��mol-1���÷�Ӧ��
1000���ƽ�ⳣ������4����һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1. 0mol,��Ӧ����l0min��ﵽƽ�⡣
��1��CO��ƽ��ת����=____________
��2�������CO��ƽ��ת����,�ٽ�Fe2O3��ת��,�ɲ�ȡ�Ĵ�ʩ��________
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ,ʹ����ƽ���������ֽӴ�
��.��¯���������ķ����е�CO�ɽ��л���,ʹ����һ�������º�H2��Ӧ�Ʊ��״�:
CO(g)+ 2H2(g) CH3OH(g)�������ͼʾ�ش���������:
CH3OH(g)�������ͼʾ�ش���������: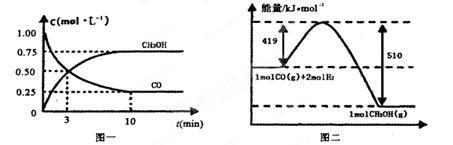
��1���ӷ�Ӧ��ʼ��ƽ��,��H2Ũ�ȱ仯��ʾƽ����Ӧ����v(H2)=________
��2�������¶Ⱥ�������ͬ�������ܱ�������,����ͬ��ʽͶ�뷴Ӧ��,��÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| ���� | ��Ӧ��Ͷ����� | ��Ӧ��� ת���� | CH3OH��Ũ�� | �����仯 (Q1��Q2��Q3������0) |
| �� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com