
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);
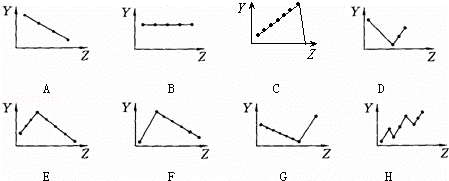
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数 (2)ⅦA族元素氢化物的沸点
(3)第三周期元素单质的熔点 (4)第三周期元素的最高正化合价
(5)IA族元素单质熔点 (6)F﹣、Na+、Mg2+、Al3+四种离子的离子半径 .
考点: 原子结构与元素周期律的关系.
分析: (1)同一主族元素价电子数相等,与原子序数无关;
(2)ⅦA族元素氢化物的沸点随着原子序数增大而呈增大趋势,但HF沸点最高;
(3)第三周期元素单质的熔点随着原子序数增大先增大后减小;
(4)第三周期元素的最高正化合价随着原子序数增大而增大;
(5)IA族元素单质熔点随着原子序数增大而减小;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小.
解答: 解:(1)同一主族元素价电子数相等,与原子序数无关,第IIA族元素价电子数都是2,故答案为:B;
(2)ⅦA族元素氢化物的晶体都是分子晶体,与其相对分子质量成正比,所以VIIA氢化物的沸点随着原子序数增大而呈增大趋势,但HF中含有氢键导致沸点最高,
故答案为:D;
(3)第三周期元素单质晶体类型依次为:金属晶体、原子晶体、分子晶体,所以其单质的熔点随着原子序数增大先增大后减小,原子晶体Si熔点最高,
故答案为:E;
(4)第三周期元素的最高正化合价随着原子序数增大而增大,故答案为:C;
(5)IA族元素单质中氢气是非金属单质,其余都是金属晶体,氢气单质的熔点最低,金属晶体的熔点与其原子半径成反比,所以碱金属族单质的熔点随着原子序数增大而减小,故答案为:F;
(6)电子层结构相同的离子其离子半径随着原子序数增大而减小,F﹣、Na+、Mg2+、Al3+四种离子的离子半径依次减小,故答案为:A.
点评: 本题考查原子结构和元素性质,侧重考查元素周期律,熟练掌握同一周期、同一主族元素性质变化规律,并灵活运用这些规律解题,注意规律中的异常现象,注意(5)中第IA族元素要考虑H元素,为易错点.


科目:高中化学 来源: 题型:
下列是4位同学在学习“化学反应的速率和化学平衡“一章后,联系工业生产实际所发表的观点,你认为不正确的是()
A. 化学反应速率理论是研究怎样在一定时间内快出产品
B. 化学平衡理论是研究怎样使用有限原料多出产品
C. 化学反应速率理论是研究怎样提高原料转化率
D. 化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ksp(AgCl)=1.56×10﹣10,Ksp(AgBr)=7.7×10﹣13,Ksp(Ag2CrO4)=9.0×10﹣12.某溶液中含有Cl﹣、Br﹣和CrO42﹣浓度均为0.010mol•L﹣1,向该溶液中逐滴加入0.01 0mol•L﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()
0mol•L﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()
A. Cl﹣、Br﹣、CrO42﹣ B. CrO42﹣、Br﹣、Cl﹣
C. Br﹣、Cl﹣、CrO42﹣ D. Br﹣、CrO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2、②SiO2、③NH4Cl、④金刚石、⑤CaH2、⑥白磷,其中含有两种结合力的组合是( )
A. ①③⑤⑥ B. ②④⑥ C. ①③⑥ D. ①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于丙烯(CH3﹣CH=CH2)的说法正确的( )
A. 丙烯分子有8个σ键,1个π键
B. 丙烯分子中3个碳原子都是sp3杂化
C. 丙烯分子不存在非极性键
D. 丙烯分子中3个碳原子在同一直线
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)=2H2(g)+O2(g);△H1=+571.6kJ/mol,
2H2(g)+O2(g)=2H2O(g);△H2=﹣483.6kJ/mol.
当1g 液态水变成气态水时,对其热量变化的下列描述:
①放出;②吸收;③2.44kJ;④4.88kJ;⑤88kJ,
其中正确的是()
A. ②和⑤ B. ①和③ C. ②和④ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯.在电解精炼时()
A. 粗铜接电源负极
B. 纯铜作阳极
C. 杂质都将以单质形式沉积到池底
D. 纯铜片增重2.56g,电路中通过电子为0.08mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com