
在25℃时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则充分反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.将pH=4的醋酸溶液与pH=10的KOH溶液等体积混合,则充分反应后的混合液:c(CH3COO-)>c(H+)>c(K+)>c(OH-)
D.某物质的溶液中由水电离出c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
A
【解析】
试题分析:A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后所得溶液是由等物质的量浓度的HA和NaA组成的,pH大于7,这说明A—的水解程度大于HA的电离程度,则根据物料守恒2c(Na+)=c(HA)+c(A-)和电荷守恒c(OH-)+c(A-)=c(H+)+c(Na+)可知充分反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-),A正确;B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,由于不能确定溶质,因此离子浓度的大小关系不一定是:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),B错误;C.醋酸时弱酸,将pH=4的醋酸溶液与pH=10的KOH溶液等体积混合后醋酸过量溶液向酸性,则充分反应后的混合液:c(CH3COO-)>c(K+)>c(H+)>c(OH-),C错误;D.某物质的溶液中由水电离出c(H+)=1×10-amol/L,若a>7时,说明水的电离被抑制,则溶液可能显酸性,也可能显碱性,因此该溶液的pH不一定为14-a,D错误,答案选A。
考点:考查溶液中离子浓度大小比较


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)滴定实验是化学学科中重要的定量实验。请回答下列问题:
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250 mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)用_____滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液。
(2)试样中NaOH的质量分数为______________________。
(3)若出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是________________。
Ⅲ.沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市高二下学期学业水平模拟化学试卷(解析版) 题型:填空题
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题, 选学《有机化学基础》模块的考生.答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》:
(1)、(4分)良好的生态环境可以提升生活质量。
①提倡“光盘行动”,有利于“勤俭节约”、减少厨余垃圾,厨余垃圾的标识为 _ (填宇母)。

②下列物质中,不能用于饮用水杀菌消毒的是_ (填字母)。
a.漂白粉 b.乙醇 c.二氧化氯
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是_ (填字母)。
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金厲离子
c.用氯气除去废水中的悬浮物
④某地区各空气污染物指数为S0278、NO2 43、可吸入颗粒物153。该地K的首要污染物为_ 。
(2)、(6分)保证食品安全,合理用药,是人体健康的基础。
①营养平衡、科学使用食品添加剂有助于健康和提髙免疫力。下列物质常用作食品防腐剂的是_ (填字母)。
a.苯甲酸钠 b.味精 c.柠橡黄
②下列药品属F国际奥委会严格禁止的兴奋剂是_ (填字母)。
a.阿司匹林 b.青霉素 c.吗啡
③氨基酸分子中含有的官能团是氨基(一NH2)和_ (写名称)。人体中共有 20多种氨基酸,其中人体自身_ (填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
④如何检验糖尿病患者的尿液中含有葡萄糖?写出实验操作方法、现象和结论:_
(3)、(5分)化学与材料密切关联。
①下列塑料可用作不粘锅的表血材料的是 (填字母)。
a.聚氯乙烯 b.聚四氟乙烯 c.有机玻璃
②下列关于铁制品保护措施的说法中不正确的有 (填字母)。
a.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
b.将不锈钢制成刀其和餐具,有的刀具还进行烤蓝处理
c.在海轮的外壳上常焊有铜块,且定期更新
③钢筋泡凝土属于 材料。(填字母)
a.复合材料 b.无机非金属材料 c.金属材料
④氧气和四氯化硅蒸气在旋转的岛温炉中发生罝换反应,其产物之一可制得光导纤维,试写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
用聚光手电筒照射下列分散系,不能观察到丁达尔效应的是
A.KOH溶液 B.Fe(OH)3胶体 C.淀粉溶液 D.蛋白质溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市四校高三3月联合考试理综化学试卷(解析版) 题型:填空题
(12分) 硫酸锌被广泛应用于工农业生产和医药领域.工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:

(1)步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时为防堵塞,过滤装置需常用NaOH溶液清洗,其清洗原理是 (用化学方程式表示)。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
(3)步骤Ⅲ所得滤渣Z的主要成分是 。
(4)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。

①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②在图中C点,680 ℃时所得固体的化学式为 (填字母序号)。
a.ZnO b.ZnSO4 c.ZnSO4·H2O d.Zn3O(SO4)2
d.Zn3O(SO4)2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市四校高三3月联合考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.玛瑙的主要成分为硅酸盐 B.pH小于7的雨水属于酸雨
C.漂白粉的有效成分是次氯酸钙 D.工业上用电解熔融的氯化铝冶炼铝
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
下述实验不能达到预期实验目的是
序号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:填空题
(15分)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)试剂X为_________(填化学式),发生反应的离子反应方程式为_________。
(2)滤渣2的成分是_________(填化学式)。
(3)操作3包括_________、冷却结晶、_________、洗涤、干燥等一系列操作,在此过程中玻璃棒的作用是_________(填代号)
①引流 ②搅拌加速溶解 ③搅拌使溶液受热均匀,防止暴沸
(4)煅烧过程存在以下反应:2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是_________(填化学式)。
②B中盛放的溶液可以是_________(填字母)。
A.NaOH溶液 b.Na2CO3溶液 c.KMnO4溶液 d.稀硝酸
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:实验题
【化学—选修2化学与技术】(15分)
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
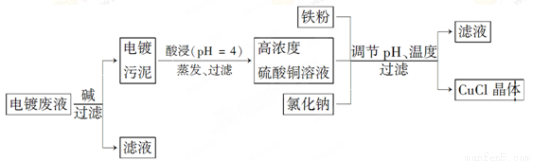
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:____________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com