
| A.核裂变是一种化学变化 |
| B.12753I的质量数为127,原子序数为53,核内有74个中子 |
| C.碘12753I和放射性碘13153I属于同素异形体 |
| D.12753I与13153I是同一种核素 |
科目:高中化学 来源:不详 题型:单选题
| A.氢化物沸点:HI>HBr>HCl>HF | B.离子半径:K+>Cl->S2- |
| C.分子稳定性:HF>HCl>HBr>HI | D.单质熔点:Li<Na<K<Rb |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为: 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
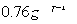 ;W的质子数是X、Y、Z、M四种元素质子数之和的
;W的质子数是X、Y、Z、M四种元素质子数之和的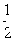 。下列说法正确的是
。下列说法正确的是| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
 案:
案:
 100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。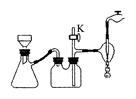
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
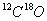 和
和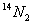 两种气体,关于这两个容器中气体的说法正确的是
两种气体,关于这两个容器中气体的说法正确的是| A.原子数和中子数都相等 | B.分子数和质量都不相等 |
| C.分子数和质量都相等 | D.质子数相等,质量不等翰林汇 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 反应的化学方程式:____________________________。
反应的化学方程式:____________________________。A. (CN)2+2NaOH===NaCN+NaCNO+H2O (CN)2+2NaOH===NaCN+NaCNO+H2O | |
| B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O | C.I2+2KCN===2KI+(CN)2 |
| D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳、氮原子构成网状结构的原子晶体 |
| B.膜中C—N键的键长比金刚石中的C—C键的键长短 |
| C.碳、氮同属非金属元素,化合时放出大量热 |
| D.由相邻主族的非金属元素所形成的化合物都比单质的硬度大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
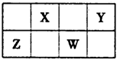
| A.通常情况下,X元素只存在两种氧化物 |
| B.Y元素气态氢化物的还原性最强 |
| C.X元素的非金属性比Y元素非金属性强 |
| D.Z和X可能以共价键结合形成一种无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com