
【题目】金属及其化合物在生产中用途广泛。
Ⅰ利用生产硼砂的废渣一一确镁泥(主要成分为MgCO3.SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3:Mg(OH)2:2H2O]的工业流程如下:
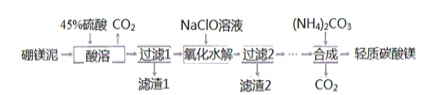
(1)写出“酸溶"一步中,MgCO3和硫酸反应的离子方程式________________________。
(2)滤渣2的主要成分有MnO2和____,写出生成MnO2的离子方程式_____________。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是________。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
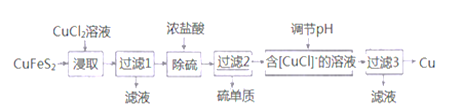
已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_______________。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为__________。
(6)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是______。(填离子符号)
【答案】MgCO3+2H+=Mg2++H2O+CO2↑ Fe(OH)3 Mn2++ClO-+H2O=MnO2↓+2H++Cl- (NH4)2CO3 受热分解(或(NH4)2CO3![]() 2NH3↑+H2O+CO2↑) CuFeS2+3FeCl3=CuCl↓+ 4FeCl2+2S↓ Fe2O3 Cu2+
2NH3↑+H2O+CO2↑) CuFeS2+3FeCl3=CuCl↓+ 4FeCl2+2S↓ Fe2O3 Cu2+
【解析】
根据已知条件,CuFeS2加入CuCl2浸取发生CuFeS2+3CuCl2=4CuCl+FeCl2+2S,过滤后得到滤液含有FeCl2,固体含有CuCl、S,加入盐酸除硫,过滤得到滤液含有[CuCl2]-,调节溶液pH发生歧化反应生成Cu和Cu2+,过滤可得到Cu,得到滤液含有Cu2+,以此解答该题。
由制备流程可知,硼镁泥的主要成分为MgCO3、SiO2,还有少量Fe2O3、MnO、CaO等,向废渣中加硫酸时SiO2不溶解,过滤得到滤渣1为二氧化硅,NaClO具有氧化性,能将Mn2+氧化为MnO2,调节PH生成MnO2、Fe(OH)3沉淀,过滤得滤渣2为MnO2、Fe(OH)3,再经过系列除杂后所得溶液中加碳酸铵溶液,得到轻质碳酸镁;
(1)MgCO3和硫酸反应生成硫酸镁和二氧化碳,反应方程式为MgCO3+H2SO4=MgSO4+CO2↑+H2O,硫酸过量可以使碳酸镁充分溶解生成硫酸镁,故答案为:MgCO3+2H+=Mg2++H2O+CO2↑;
(2) 根据上面的分析可知滤渣2的主要成分为MnO2、Fe(OH)3,次氯酸钠能氧化锰离子生成MnO2,反应的离子方程式为Mn2++ClO-+H2O═MnO2↓+2H++Cl-,故答案为:Fe(OH)3;Mn2++ClO-+H2O═MnO2↓+2H++Cl-;
(3) “合成”时在溶液中加碳酸铵溶液,得到轻质碳酸镁、硫酸铵和水,温度过低反应速率慢,温度过高轻质碳酸镁、碳酸铵会分解,故答案为:温度过低反应速率慢,温度过高轻质碳酸镁、碳酸铵会分解,(NH4)2CO3 受热分解(或(NH4)2CO3![]() 2NH3↑+H2O+CO2↑);
2NH3↑+H2O+CO2↑);


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
I.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) △H1 =a kJ/ mol
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=_________kJ/mol(用含a、b的代数式表示)
Ⅱ.一定条件下,CO2和CO可以互相转化。
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
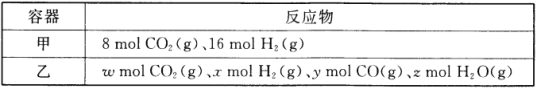
甲容器15min后达到平衡,此时CO2的转化率为75%。则0~15min内平均反应速率v(H2)= _________,此条件下该反应的平衡常数K=_________。
欲使平衡后乙与甲中相同组分气体的体积分数相等,则ω、x、y、z需满足的关系是_________,且_________ (用含y的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) △H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g) △H”中乙苯的平衡转化率影响如下图所示:
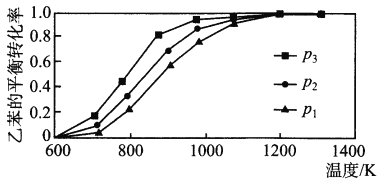
则△H_________ 0(填“>”“<”或“=”),压强p1、p 2、p3从大到小的顺序是_________。
(3)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_________。
CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成:

回答下列问题:
(1)11.2 L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45gH2O。A的分子式是___________。
(2)D的名称(系统命名)为____________________;
(3)在催化剂存在下1mol F与2 mol H2反应,生成3-苯基-1-丙醇,F的结构简式是_______________;
(4)反应①的反应类型是___________________;
(5)反应②的化学方程式为___________________;
(6)与G具有相同的官能团的芳香类同分异构体有________种(不含G),其中HNMR中有五组峰,峰面积比为1∶1∶2∶2∶2的异构体的结构简式:___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子核外M层上有3个电子,元素Y形成的离子Y2-核外有18个电子,则这两种元素可形成化合物( )
A.XY2B.X2Y3C.X3Y2D.X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。D能与碳酸钠反应产生气体,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
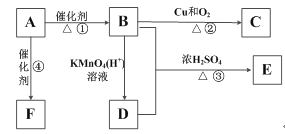
(1)A的结构简式为_____。
(2)B分子中的官能团名称是_____,F的结构简式为_______________。
(3)写出下列反应的化学方程式并指出反应类型:
②_____________________________________________:反应类型是_____;
③_____________________________________________;反应类型是_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种无毒、用途广泛的化工原料,被誉为当今有机合成的“新基石”。
(1)浙江大学用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC的研究开发。已知:
(ⅰ)CO的标准燃烧热:283.0 kJmol﹣1,
(ⅱ)1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
(ⅲ)2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) △H=﹣15.5kJmol﹣1
CH3OCOOCH3(g)+H2O(g) △H=﹣15.5kJmol﹣1
则2CH3OH(g)+CO(g)+1/2O2(g) ![]() CH3OCOOCH3(g)+ H2O(l) △H=______.
CH3OCOOCH3(g)+ H2O(l) △H=______.
该反应在常压和70~120℃条件下就能自发反应的原因是___________________.
(2)甲醇和CO2可直接合成DMC:
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g),但由于甲醇转化率通常不会超过1%,因此制约该反应走向工业化生产.
CH3OCOOCH3(g)+H2O(g),但由于甲醇转化率通常不会超过1%,因此制约该反应走向工业化生产.
①写出该反应平衡常数表达式:______________________________.
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是__________(选填编号)。
A.v正(CH3OH)=2v逆(CO2) B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变 D.容器内压强不变

③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10﹣5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。(计算公式:TON=转化的甲醇的物质的量/催化剂的物质的量)在该温度下,最佳反应时间是_____;4~10h内DMC的平均反应速率是_______.
④如果在其它条件不变的情况下,研究反应温度对甲醇转化数(TON)的影响,请在图的坐标系中画出从投入反应物开始,随着反应温度不断升高(不考虑温度对催化剂活性的影响),TON变化的曲线示意图(假设起始温度为T0℃)__________________.

⑤假设在密闭容器中发生上述反应,达到平衡时下列措施能提高TON值的是______.
A.往反应体系中添加催化剂 B.往反应体系中添加吸水剂
C.从反应体系中分离出CO2 D.扩大容器的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RO4n-离子在一定条件下可以把CI-离子氧化为ClO-,若RO4n-离子变为RO32-离子,又知反应中RO4n-与Cl-的物质的量之比为1:1,则RO4n-中R元素的化合价为 ( )
A. +4 B. +5 C. +6 D. +7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com