
【题目】图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.请填写以下空白: 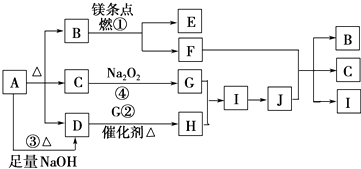
(1)A中含有的化学键是 .
(2)写出铜与J反应制取H的化学方程式:
(3)写出反应③的离子方程式: .
(4)写出物质B的电子式:;写出物质E的电子式: .
(5)在反应④中,当生成标况下22.4L 物质G时,转移电子数为mol.
【答案】
(1)离子键、极性共价键
(2)3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
(3)NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O
NH3↑+CO32﹣+2H2O
(4)![]() ;
;![]()
(5)2
【解析】解:A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,C能和过氧化钠反应,则C为水或二氧化碳,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,C为水,水和过氧化钠反应生成NaOH和O2 , D能在催化剂条件下反应生成H,则D是NH3 , G是O2 , H是NO,I是NO2 , J是HNO3 , 镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3 ,
(1.)A为NH4HCO3 , 铵根离子和碳酸氢根离子间含有离子键、铵根离子、碳酸氢根离子中含极性共价键,
所以答案是:离子键、极性共价键;
(2.)出铜与J为HNO3反应生成硝酸铜、一氧化氮和水,反应的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,
所以答案是:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
(3.)反应③是在加热条件下,碳酸氢铵和氢氧化钠反应的离子方程式为:NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O,
NH3↑+CO32﹣+2H2O,
所以答案是:NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO32﹣+2H2O;
NH3↑+CO32﹣+2H2O;
(4.)物质B为CO2 , 分子中碳原子和氧原子分别写出两个共价键,二氧化碳的电子式为: ![]() ,E为氧化镁属于离子化合物,电子式为:
,E为氧化镁属于离子化合物,电子式为: ![]() ,
,
所以答案是: ![]() ;
; ![]() ;
;
(5.)水和过氧化钠反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,当生成标况下22.4L 氧气时转移电子的物质的量= ![]() ×2×(1﹣0)=2mol,
×2×(1﹣0)=2mol,
所以答案是:2.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③⑤⑦ D. ③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 溴水中有平衡:Br2+H2O![]() HBr+ HBrO加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO加入 AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+ NO2(g)![]() CO2(g)+NO(g)平衡体系增大压强可使颜色变深
CO2(g)+NO(g)平衡体系增大压强可使颜色变深
C. 升高温度能够增大硝酸钾在水中的溶解度
D. 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能通过一步反应直接实现的是
A(HCl)←B(Cl2)→C(Ca(ClO)2)→D(HClO)→E(CO2)
A. B→A B. B→C C. C→D D. D→E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)写出实验室制备氨气的化学方程式:______________________________ ;氨的水溶液显弱碱性,其原因为__________________________(用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”) ;若加入少量的明矾,溶液中的NH的浓度________(填“增大”或“减小”) 。
(2)硝酸铵加热分解可得到N2O和H2O。250 ℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为________________________________,平衡常数表达式为________;若有1 mol硝酸铵完全分解,转移的电子数为________mol。
(3)将pH=12的氨水和pH=2的盐酸等体积混合后溶液呈______性。
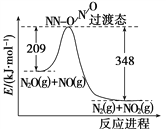
(4)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法符合《食品卫生法》的是 ( )
A. 用SO2熏制银耳 B. 在奶粉中添加三聚氰胺
C. 用苏丹红做食品添加剂 D. 用小苏打作焙制糕点的发酵粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是___________;如果是多种成分,可能是__________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
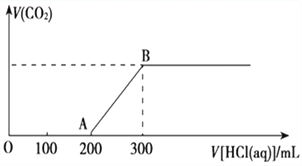
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式:_______。
②B点时,反应所得溶液中溶质的物质的量浓度是_________ (溶液体积的变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.强酸和强碱一定是强电解质,不论其水溶液浓度大小,都能完全电离
B.强电解质溶液的导电能力一定比弱电解质强
C.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强
D.强电解质不一定都是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com