

| A. | 作为测量中和反应反应热的装置图,从玻璃仪器的角度看,图1还缺少环形玻璃搅拌棒 | |
| B. | 检验图2装置的气密性时,向漏斗中加水若出现图中所示的现象,可以证明该气密性良好 | |
| C. | 已知图3是利用原电池检验空气中Cl2含量的装置,其中Pt电极作负极 | |
| D. | 根据图4的溶解度变化可知,在较低温度下容易分离MgSO4•7H2O和CaSO4•2H2O |
分析 A.大小烧杯口应相平,可防止热量散失;
B.检验图2装置的气密性时,利用液柱法检验气密性即可;
C.由2Ag+Cl2=2AgCl及装置可知,Ag失去电子作负极;
D.由图可知,温度高于40℃时MgSO4•7H2O和CaSO4•2H2O溶解度差异较大.
解答 解:A.大小烧杯口应相平,可防止热量散失,且图1还缺少环形玻璃搅拌棒,故A错误;
B.检验图2装置的气密性时,关闭止水夹,向漏斗中加水若出现图中所示的现象,且一段时间液柱高度不变,则可以证明该气密性良好,故B正确;
C.由2Ag+Cl2=2AgCl及装置可知,Ag失去电子作负极,而Pt电极作正极,故C错误;
D.由图可知,温度高于40℃时MgSO4•7H2O和CaSO4•2H2O溶解度差异较大,则在较高温度下容易分离MgSO4•7H2O和CaSO4•2H2O,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力与实验能力的考查,注意把握中和热测定实验、气密性检验、原电池及溶解度等为解答的关键,题目难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
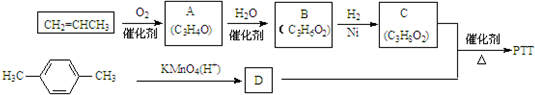
 .①分子式为C4H6O ②含有1个-CH3
.①分子式为C4H6O ②含有1个-CH3 ,反应类型为缩聚反应.
,反应类型为缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 g O2中含有的氧分子数为NA | |
| B. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 1 mol•L-1 CaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步 骤 | 现 象 |
| Ⅰ.将NaCl溶液与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.将Ⅱ中经过滤洗得到的黑色沉淀分成两份,在一份沉淀中加蒸馏水,另一份沉淀中加入NaCl溶液,同时浸泡较长时间. | 加蒸馏水的沉淀仍为黑色,加入NaCl溶液的沉淀变为乳白色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com