
有A、B、C、D四种金属,做如下实验:①将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;②将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈;③将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.A>B>C>D B.C>D>A>B
C.D>A>B>C D.A>B>D>C
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)质子数为35、中子数为45的溴原子: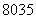 Br( )
Br( )
(2014·江苏,2B)
(2)硫离子的结构示意图: ( )
( )
(2014·江苏,2C)
(3)核外电子排布相同的微粒化学性质也相同( )
(2014·山东理综,8B)
(4)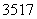 Cl与
Cl与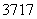 Cl得电子能力相同( )
Cl得电子能力相同( )
(2014·山东理综,8D)
(5)氯原子的结构示意图: ( )
( )
(2013·江苏,2C)
(6)中子数为146、质子数为92的铀(U)原子: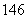 92U( )
92U( )
(2013·江苏,2D)
(7)原子核内有18个中子的氯原子: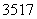 Cl( )
Cl( )
(2012·海南,9D)
(8)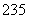 92U和
92U和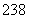 92U是中子数不同质子数相同的同种核素( )
92U是中子数不同质子数相同的同种核素( )
(2012·天津理综,3C)

(9)元素周期表中铋元素的数据见右图,则:
①Bi元素的质量数是209( )
②Bi元素的相对原子质量是209.0( )
(2012·上海,6改编)
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,在含4 g NaOH溶质的溶液中通入一定量的CO2,将溶液蒸干并灼烧,最后得到的固体可能是( )
A.0.1NA的NaHCO3
B.0.05NA Na2CO3
C.0.05NA~0.1NA Na2CO3和NaHCO3混合物
D.0.1NA的NaHCO3和NaOH混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2 mL 0.1 mol·L-1 FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
| Ⅱ | 先向2 mL 0.1 mol·L-1 FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol·L-1 KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加KI溶液后,血红色无明显变化 |
①实验Ⅰ的现象为________________________________________________。
②FeCl2溶液与新制氯水反应的离子方程式为____________________________
________________________________________________________________________。
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进。改进后的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL | |
| 0.1 mol·L-1 FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由:_____________________________________________。
(3)该同学认为需要进一步设计实验,证明根据实验Ⅲ中现象得出的结论。请补全下表中的实验方案:
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL 0.1 mol·L-1 FeCl3溶液,__________ |
(4)上述实验结果表明,Fe3+有可能与I-发生氧化还原反应。进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同。该同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红的原因,认为Fe3+与I-反应的离子方程式应写为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
电工经常说的一句口头禅:“铝接铜,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,试说明原因:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg===Mg2++2Ag+2Cl-
试书写该电池的正、负极电极反应式。
查看答案和解析>>
科目:高中化学 来源: 题型:
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成的原电池,负极反应式为Al-3e-===Al3+
B.由Mg、Al、NaOH溶液组成的原电池,负极反应式为Al-3e-+4OH-===AlO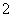 +2H2O
+2H2O
C.由Fe、Cu、FeCl3溶液组成的原电池,负极反应式为Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成的原电池,负极反应式为Cu-2e-===Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

| 模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;
实验过程中,假设溶液体积不变。
Ksp(CaCO3)=4.96×10-9
Ksp(MgCO3)=6.82×10-6
Ksp[Ca(OH)2]=4.68×10-6
Ksp[Mg(OH)2]=5.61×10-12
下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com