
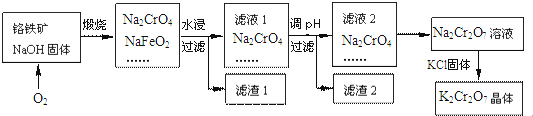
分析 铬铁矿通过焙烧,生成Na2CrO4、NaFeO2、Na2SiO3、NaOH和NaAlO2的混合体系,然后加水溶解得固体氢氧化铁和溶液Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全沉淀,硅酸盐完全沉淀;继续调节溶液的pH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)根据化合价规则来计算元素的化合价;
(2)根据Na2CrO4和NaFeO2的性质来回答;
(3)根据NaFeO2的性质以及氧化铝和二氧化硅的性质来回答;
(4)工业上电解氧化铝来生产金属铝;
(5)铬酸根在酸性条件下可以转化为重铬酸根;
(6)根据物质的溶解度随温度的变化来分析.
解答 解:(1)根据化合价规则:化合物中各个元素的化合价代数和是0,K是+1价,O是-2价,所以K2Cr2O7中Cr元素的化合价是+6,
故答案为:+6;
(2)Na2CrO4和NaFeO2反应的化学方程式是:4FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O,
故答案为:4FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O;
(3)NaFeO2和水反应会产生红褐色沉淀,即NaFeO2+2H2O=NaOH+Fe(OH)3↓,生成的氢氧化钠和氧化铝反应生成偏铝酸钠,和二氧化硅反应生成硅酸钠,滤液1的成分除Na2CrO4外,还含有偏铝酸钠和硅酸钠,
故答案为:氢氧化铁;NaAlO2、Na2SiO3;
(4)滤渣2可制得两种氧化物,其中一种氧化物氧化铝经电解冶炼可获得金属铝,该电解反应的化学方程式是:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(5)根据题目信息:2CrO42-+2H+?Cr2O72-+H2O,所以滤液2中的铬酸钠转化为Na2Cr2O7溶液应采取的措施是加硫酸酸化,
故答案为:加硫酸酸化;
(6)向Na2Cr2O7溶液中加入KCl固体,加热时,重铬酸钠的溶解度随温度的升高而增大,但是氯化钾的受温度影响不大,所以获得K2Cr2O7晶体的操作依次是:加热浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:冷却结晶.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
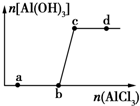 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Mg2+、SO42-、HCO3- | |
| B. | b点对应的溶液中:Ag+、Ca2+、NO3-、F- | |
| C. | c点对应的溶液中:Na+、S2-、SO42-、Cl- | |
| D. | d点对应的溶液中:K+、NH4+、I-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气光照下反应的生成的氯代物都是气体 | |
| B. | 正丁烷的四个碳原子在同一条直线上 | |
| C. | 正丁烷的熔点、沸点都比异丁烷小 | |
| D. | 分子式为CnH2n+2分子中共用电子对数为3n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某课外活动小组模拟工业制备纯碱,方案如下:
某课外活动小组模拟工业制备纯碱,方案如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与足量盐酸混合:Ca(HCO3)2+2H+═Ca2++2CO2↑+2H2O | |
| B. | Na2CO3溶液中通入CO2气体:CO${\;}_{3}^{2-}$+CO2+H2O═2HCO${\;}_{3}^{-}$ | |
| C. | 实验室用NH4Cl固体与Ca(OH)2固体混合制NH3:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO${\;}_{3}^{2-}$+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com