
 乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )
乙醛在518℃时经途径Ⅰ或途径Ⅱ分解为甲烷和一氧化碳,如图所示是两途径的能量变化曲线示意图.下列叙述中,错误的是( )| A. | 在其他条件不变时,途径Ⅰ与途径Ⅱ中乙醛的转化率相同 | |
| B. | 途径Ⅱ是加入催化剂时能量变化曲线,且催化剂是I2 | |
| C. | 途径Ⅰ与途径Ⅱ的焓变(△H)相同 | |
| D. | 加入催化剂将增大正反应速率,降低逆反应速率 |
分析 途径Ⅰ与途径Ⅱ相比较,途径Ⅱ能量较低,应加入催化剂,催化剂降低反应的活化能,但平衡不发生移动,反应的焓变不变,同等程度增大反应速率,以此解答该题.
解答 解:A.途径Ⅰ与途径Ⅱ反应物和生成物相同,为加入催化剂的影响,平衡不移动,转化率相等,故A正确;
B.途径Ⅱ加入催化剂,反应中碘为催化剂,反应前后的质量、性质不变,故B正确;
C途径Ⅰ与途径Ⅱ反应物和生成物相同,则焓变相等,故C正确;
D.催化剂同等程度改变反应速率,故D错误.
故选D.
点评 本题综合考查反应热与焓变、催化剂对平衡移动的影响等知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握图象的分析以及平衡移动的催化剂对化学平衡的影响,难度不大.


科目:高中化学 来源: 题型:选择题
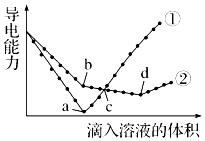 常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | B. | b点,水电离产生的c(H+)<10-7mol/L | ||
| C. | c点,两溶液中含有相同量的 OH- | D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定 序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
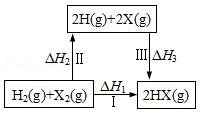
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2>0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | △H1代表H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
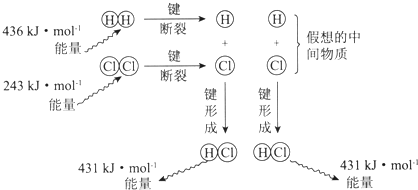
| A. | 该反应的反应热△H=-183kJ•mol-1 | |
| B. | 该反应生成液态HCl比生成气态HCl释放的能量少 | |
| C. | 氯气分子中的化学键比氢气分子中的化学键更稳定 | |
| D. | 1 mol HCl分子中的化学键形成时吸收431kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
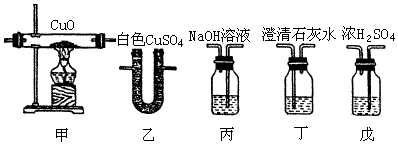
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com