
分析 I.(1)铁元素是26号元素,铁原子核外有26个电子,铁原子失去3个电子变成铁离子,根据构造原理写出其价电子排布式;
(2)根据碳原子含有的σ键和孤电子对个数确定杂化类型,碳原子的杂化轨道和氢原子的1s轨道形成化学键;
Ⅱ.(1)Ni(CO)4中配体是CO,CO的等电子体是与其原子个数相等且价电子数相等的分子或离子;
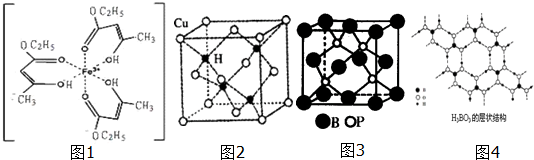
(2)利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式计算,设晶胞的边长为a,再根据晶胞中Cu原子与H原子之间的最短距离为体对角线的$\frac{1}{4}$,据此答题;
Ⅲ.(1)首先判断中心原子形成的δ键数目,然后判断孤对电子数目,以此判断杂化类型,结合价层电子对互斥模型可判断分子的空间构型;
(2)根据磷化硼的晶体结构解答;
(3)①利用均摊法计算含1molH3BO3的晶体中的氢键;
②B原子外层3个电子,硼酸(H3BO3)结合水电离出的氢氧根离子显较弱的酸性.
解答 解:I.(1)铁元素是26号元素,其原子核外有26个电子,铁原子失去3个电子变成铁离子,其价电子排布式为:3d5,故答案为:3d5;
(2)甲基和乙基上的碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化,碳碳双键两端的碳原子含有3个σ键且不含孤电子对,所以采取杂化sp2,-C2H5中C-H间碳原子的sp3杂化轨道和氢原子的1s轨道形成化学键,
故答案为:碳原子的sp3杂化轨道;氢原子的1s轨道;
Ⅱ.(1)CO分子中含有2个原子,其价电子个数是10,所以与Ni(CO)4中配体互为等电子的离子是CN-、C22-;
故答案为:CN-、C22-;
(3)该晶胞中含有4个H原子,铜原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶胞中含有4个铜原子4个氢原子,设该晶胞的边长为a,则a=$\root{3}{\frac{4×65}{ρ{N}_{A}}}$,再根据晶胞中Cu原子与H原子之间的最短距离为体对角线的$\frac{1}{4}$,而体对角线为$\sqrt{3}$a,所以Cu原子与H原子之间的最短距离为$\frac{\sqrt{3}}{4}×\root{3}{\frac{4×65}{ρ{N}_{A}}}$cm,故答案为:$\frac{\sqrt{3}}{4}×\root{3}{\frac{4×65}{ρ{N}_{A}}}$;
Ⅲ.(1)BF3中B原子形成3个δ键,孤对电子数为$\frac{3-3×1}{2}$=0,BF3中价层电子对个数=3+0=3,且不含孤电子对,所以空间构型是平面三角形,中心原子是以sp2杂化,
故答案为:平面三角形;sp2;
(2)由图可知,B原子分别与三个P原子形成共价键,则磷化硼的化学式为BP,所以微粒间存在的作用力为共价键,
故答案为:BP;共价键;
(3)①一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,故答案为:3;
②硼酸中B原子属于缺电子原子,在水溶液中结合水电离出的氢氧根离子,B(OH)3+H2O?B(OH)4-+H+,破坏了水的电离平衡而使溶液显酸性,所以硼酸为一元酸,[B(OH)4]-含有的化学键类型为共价键、配位键,
故答案为:一;共价键、配位键.
点评 本题考查较为综合,题目难度中等,涉及晶胞的计算、价电子排布式的书写、等电子体等知识点,对学生的空间想象有一定要求,侧重考查学生对知识的迁移应用,注意信息的理解和综合应用.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| B. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原性二糖 | |
| C. | 若两种二肽互为同分异构体,则二者的水解产物一定不同 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | |
| B. | 葡萄糖在人体内氧化分解 | |
| C. | 二氧化碳与赤热的碳反应生成一氧化碳 | |
| D. | 锌粒与稀H2SO4反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) | |
| B. | 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 | |
| C. | 若误饮c(Ba2+)=1.0×10-5 mol•L-1的溶液时,会引起钡离子中毒 | |
| D. | 可以用0.36 mol•L-1的Na2SO4溶液给钡离子中毒患者洗胃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③>①>④>② | B. | ①>②>③>④ | C. | ③>②>①>④ | D. | ①>④>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:F>O>S | B. | 金属性:Rb>K>Li | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的最高正化合价:N>S | B. | 热稳定性:HCl>HI | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com