
【题目】(1)比较给出![]() 能力的相对强弱:
能力的相对强弱:![]() ________
________![]() (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明![]() 和
和![]() 结合
结合![]() 能力的相对强弱________。
能力的相对强弱________。
(2)![]() 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )
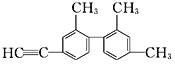
A. 分子中处于同一直线上的碳原子最多有6个
B. 该烃苯环上的二氯代物共有13种
C. 该烃的一氯代物共有8种
D. 分子中至少有12个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
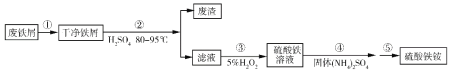
回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
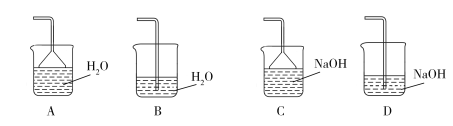
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中正确的是

A. a极要与Y极连接
B. N电极发生还原反应,当N电极消耗5.6L(标准状况下)气体时,则a电极增重64g
C. 不论b为何种电极材料,b极的电极反应式一定为2C1--2e-=Cl2↑
D. 若有机废水中主要含有乙醛,则图甲中M极发生的电极应为:CH3CHO+3H2O-l0e-=2CO2↑+l0H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池可长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-=FeO![]() +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如图:

回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是___。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有___溶液的烧杯中,充分搅拌后经___、___(填操作方法)可得纯净的Mg(OH)2。
(3)如图是该兴趣小组设计进行过程③的实验装置图:

其中装置A的作用是____。
(4)写出过程④中发生反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z是金属元素;V元素的一种核素原子核内无中子,Z元素原子的最外层只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。回答下列问题:
(1)V的一种核素中质子数为中子数的1/2,则该核素的名称为____。
(2)Z的元素符号为____。
(3)X元素的离子结构示意图为___。
(4)Y的单质在加热条件下与铁反应的化学方程式为____。
(5)W元素的原子结构示意图为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)ΔH。
2CO(g)+2H2(g)ΔH。
已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol1
C(s)+![]() O2(g)=CO(g)ΔH=-111kJ·mol1
O2(g)=CO(g)ΔH=-111kJ·mol1
该催化重整反应的ΔH=________kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___________________________。
素材1:研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为:2Li+2H2O===2LiOH+H2↑。根据以上素材回答下列问题:
(2)该电池的负极是________,负极反应式是_____________________________。
(3)正极现象是_______________________________________________。
(4)放电时OH-向_____________(填“正极”或“负极”)移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com