
【题目】能够跟1mol ![]() 起反应的Br2或H2的最大用量分别是
起反应的Br2或H2的最大用量分别是
A.1mol,1molB.3.5mol,7mol
C.1mol,7molD.6mol,7mol
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是

A.a为阴极
B.b电极反应为:2NH3-6e-=N2+6H+
C.电解一段时间后,装置内H+数目增多
D.理论上每消耗1 mol NH3,可生成1.5mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:

回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
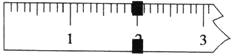
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。

按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,向100mL0.01mol/LHA的溶液中逐滴加入0.02mol/LMOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。
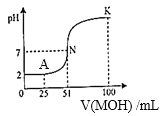
①由图中信息可知HA为______酸(填“强”或“弱”)。
②A点时,溶液中c(H+)、c(M+)、c(A-)由大到小的顺序是_____________;
③K点时,溶液中c(H+)+c(M+)-c(OH-)=_________mol/L。
(2)20℃时,在c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L的H2C2O4、NaOH混合溶液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图所示。

①Q点:c(H2C2O4)______c(HC2O4-)(填“>”、“<”或“=”)
②该温度下HC2O4-的电离常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
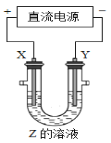
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
![]() 用浓硫酸给竹筒“刻字”是利用浓硫酸的______性。
用浓硫酸给竹筒“刻字”是利用浓硫酸的______性。
![]() 生产硅酸盐产品水泥和玻璃都需要用到的原料是______。
生产硅酸盐产品水泥和玻璃都需要用到的原料是______。
![]() 从石油中获得汽油、柴油、煤油等燃料,可用______方法分离。
从石油中获得汽油、柴油、煤油等燃料,可用______方法分离。
![]() 清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱,这种现象在化学上可称为______。
清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱,这种现象在化学上可称为______。
![]() 溴和碘及其化合物在生产生活中具有广泛的应用,如______可用于人工降雨。
溴和碘及其化合物在生产生活中具有广泛的应用,如______可用于人工降雨。
![]() 、
、![]() 、
、![]() 三者质量之比为1:2:5,则它们的氧原子数之比为______。
三者质量之比为1:2:5,则它们的氧原子数之比为______。
![]() 某金属氯化物
某金属氯化物![]() 中含有
中含有![]() ,则
,则![]() 的摩尔质量为______。
的摩尔质量为______。
![]() 高岭石化学式为
高岭石化学式为![]() ,将其改写成氧化物形式的化学式为______。
,将其改写成氧化物形式的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下表是几种常见弱酸的电离平衡常数(25℃)
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是___;下列反应不能发生的是___(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.CO32-+2HClO=CO2↑+H2O+2ClO-
c.ClO-+CH3COOH=CH3COO-+HClO
d.2ClO-+CO2+H2O=CO32-+2HClO
②碳酸钠溶液中各离子浓度从大到小的顺序依次为:___。
(2)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)__(填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);

(3)25℃时,向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__mol·L-1。
②完全沉淀后,溶液的pH=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液。
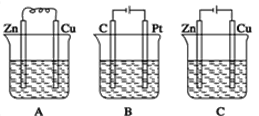
(1)A、B、C三个装置中属于原电池的是___(填标号)。
(2)A池中Zn是___极,电极反应式为___;A中总反应的离子方程式___。
(3)B池中总反应的方程式为___。
(4)C池中Zn是___极,发生___反应,电极反应式为___;反应过程中,CuCl2溶液浓度___(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )

A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com