
用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)若此盐酸的密度为1.2g/cm3,其物质的量浓度为_________________________;
(2)用双线桥表示电子的得失_________________________;
(3)此反应中氧化剂是_________,氧化产物____________;
(4)若有xmolKMnO4参加反应,则转移电子的物质的量为____________;
(5)15.8gKMnO4完全反应,产生标准状况下Cl2的体积为_________,同时有________molHCl被氧化。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届辽宁省高三全真模拟理综化学试卷(解析版) 题型:填空题
【化学选修3:物质结构与性质】Ⅰ.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是__________,N2F2分子中N原子的杂化方式是_____________,1mol N2F2含有___________个σ键.
(2)高温陶瓷材料Si3N4晶体中键角N-Si-N___Si-N-Si(填“>”“<”或“=”),原因是__________;
II.金属元素在现代工业中也占据极其重要的地位,钛也被称为“未来的钢铁”,具有质轻,抗腐蚀,硬度大,是宇航、航海、化工设备等的理想材料。
(4)基态钛原子核外共有________种运动状态不相同的电子.金属钛晶胞如下图1所示,为_______堆积(填堆积方式).

(5)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2.化合物乙的沸点明显高于化合物甲,主要原因是_____________;化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为_____________;
(6)钙钛矿晶体的结构如图3所示.假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被________个氧离子包围。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前模拟理综化学试卷(解析版) 题型:选择题
设 N A 表示阿伏加德罗常数,下列说法中正确的是( )
A.标准状况下,l L 甲醇完全燃烧后生成的 CO 2 分子个数约为(1/22.4)N A
B.N A个H 2分子的质量约为2g,它所占的体积约为 22.4L
C.标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为N A
D.500mL 0.5mol/L 的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
取两份质量相等的有机物M,一份与足量的钠反应放出气体V1L,另一份与足量NaHCO3溶液反应放出气体V2L;若同温同压下V1=V2,则M是
A.HCOOH
B.HOOC—COOH
C.HOCH2CH2COOH
D.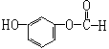
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
下列五组物质,其中一定互为同分异构体的组是
①淀粉和纤维素
②硝基乙烷 C2H5NO2和甘氨酸NH2CH2COOH
③乙酸和乙二酸
④二甲苯和苯乙烯
⑤2—戊烯和环戊烷
A.①② B.②③④ C.①③⑤ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
配制一定物质的量浓度的NaOH溶液时,使所配制的溶液浓度偏小的操作是
①烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
②定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线
③实验用的容量瓶洗净后未干燥,里面含有少量水
④定容时俯视
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
下列物质中,既能导电又属于强电解质的一组物质是
A.熔融MgCl2、熔融NaOH B.液氨、石灰水
C.石墨、食醋 D.稀硫酸、蔗糖
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高二6月月考化学试卷(解析版) 题型:选择题
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.则下列分析中正确的是( )
A.白色沉淀是CuI2,棕色溶液含有I2
B.滴加KI溶液时,转移1 mol电子时生成1 mol白色沉淀
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>SO2>I2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高一下第六次半月考化学卷(解析版) 题型:填空题
随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答问题:


(1)f在元素周期表的位置是____________________________。
(2)比较d、e常见离子的半径大小______>______(用化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性强弱___________>____________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式______________________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1 mol·L-1 R溶液的烧杯中滴加1 mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化如图所示。
① 写出m段反应的离子方程式_______________________________。
② 若在R溶液中改加20 mL 1.2 mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com