
A.6 B.8
C.4 D.12
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2014届江苏省盐城市高三上学期期中考试化学试卷(解析版) 题型:填空题
具有光、电、磁等特殊功能的新型材料是目前化学研究的热点之一,二硫醇烯与锌的配合物(C)的一种合成途径如下。

(1)锌原子基态时核外电子排布式为 。
(2)下列说法正确的是 (不定项选择)。
a.金属钠的熔点比金属锂高
b.金属钠晶体属于面心立方堆积
c.CS2的沸点比CO2高
d.硫化钠晶胞(如图所示)中含4个S2-离子

(3)化合物B中CS32-的空间构型是 (用文字描述)
(4)配合物C中Zn2+的配位数是 (填数字),N原子杂化方式是 。
(5)1mol化合物A中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源:2013届海南省高二下学期期末理科化学试卷(解析版) 题型:填空题
I.根据价层电子对互斥理论(VSEPR)可以判断分子或离子的空间构型。
请回答下列问题:
①解释CO2为直线型分子的原因 ;
② PbCl2分子的立体构型为 ,该分子属于 分子(填“极性”或“非极性” ),其中Pb原子的杂化轨道类型为 。
II.铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的X射线衍射法可以测得阿伏伽德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g/cm3,则铜晶胞的体积是
cm3,晶胞的质量是 克,阿伏伽德罗常数为
(列式计算,已知Ar(Cu)=63.6)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)晶体的最小重复单位是晶胞,晶胞一般为平行六面体。NaCl属立方面心晶格,在NaCl晶胞中8个顶点各有一个Na+,6个面心处各有一个Na+,故我们说Na+形成立方面心晶格,而在该晶胞的12条棱的中点处各有一个Cl-,在该立方晶胞的体心处还有一个Cl-,故Cl-也形成立方面心晶格。
1.KCl和NaCl的晶格型式相同。已知Na+离子的半径是Cl-离子的0.5倍,而又是K+离子的0.7倍,计算:KCl晶胞和NaCl晶胞的边长之比;KCl和NaCl晶体的密度之比。
2.将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在每两个不共面的“小立方体”中心处各放置一个C原子便构成了金刚石的一个晶胞,则一个金刚石的晶胞中有_______个C原子。并计算金刚石的密度。(已知C原子的半径为7.7×10-11m)
3.白硅石SiO2属AB2型共价键晶体。若将金刚石晶胞中的所有C原子换成Si原子,同时在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,则构成SiO2晶胞,故SiO2晶胞中有____个Si原子,____个O原子,离O原子最近的Si原子有____个,离Si原子最近的O原子有____个。
4.干冰(固态CO2)属于分子晶体。若把每个CO2分子抽象为一个质点(微粒),则其晶胞也属于立方面心晶格,故一个干冰晶胞中有_____个CO2,与1个CO2分子最近的CO2分子有_____个;在干冰分子中,原子之间靠______结合,CO2分子之间靠______结合。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)
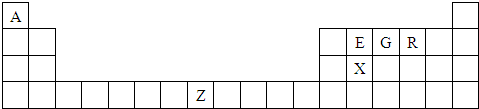
A.下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
|
| |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表
的 区。
(2)②、⑥两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(3)写出元素⑧基态原子的电子排布式 。
(4)①③两元素形成的最简单的化合物与 (写微粒符号)互为等电子体。
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于___ 晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力
为 。
(7) 金属⑦的晶体在不同温度下有两种堆积方式,晶胞分 别如右图所示。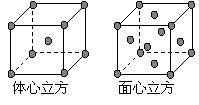 则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
B.(12分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
(1)写出反应①的平衡常数表达式K=__________________。
(2)条件相同时,反应①与反应②相比,转化程度更大的是________。以CO2为原料合成乙醇的优点是 (写出一条即可)。
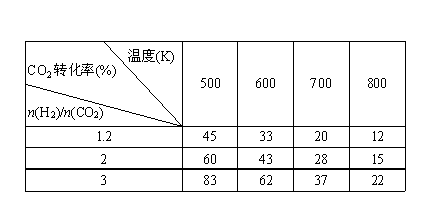 |
根据表中数据分析:
①温度升高,K值______(填“增大”、“减小”或“不变”)。
②提高氢碳比[ n(H2)/n(CO2)],对生成乙醇 (填“有利”、“不利”)。
 (4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
(4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com