
����Ŀ����1��ijͬѧ�������ʵ�鷽��̽��Ӱ��п��ϡ���ᷴӦ���ʵ����أ��й��������±���ʾ��
��� | ��п��(g) | 2.0 mol��L��1 ������Һ(mL) | �¶� (��) | ����ͭ����(g) | ��������ˮ(mL) |
�� | 2.0 | 50.0 | 25 | 0 | 0 |
�� | 2.0 | 40.0 | 25 | 0 | 10.0 |
�� | 2.0 | 50.0 | 25 | 0.2 | 0 |
�� | 2.0 | 50.0 | 25 | 4.0 | 0 |
����ʵ��������ݿ�����________________________��ʵ������ʵ��������̽��________________��п��ϡ���ᷴӦ���ʵ�Ӱ�졣
��ʵ������ʵ������Ŀ����________________��д���йط�Ӧ�����ӷ���ʽ
_______________________________________________________________��
��2��Ϊ̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±���

����Vx��________mL��������_________________________________��
��������1������Ӧ��������Ҫ��ʱ��(����ͬ�����²������������������Ҫ��ʱ��)��2�֣�
����Ũ����2�֣�
��̽������ͭ�����Է�Ӧ���ʵ�Ӱ����1�֣� Zn��Cu2��===Zn2����Cu��Zn��2H��===Zn2����H2����2�֣�
��2��2.0��1�֣� ��֤��Ӧ��K2S2O8Ũ�ȵĸı䣬����������Ũ�Ȳ�����2�֣�
����������1��ʵ������ʵ�����У�п��������״̬��ͬ�������Ũ�Ȳ�ͬ��ʵ������ʵ�����м�������ͭ��Cu2����������ǿ��H�������ȷ�����ӦZn��Cu2��===Zn2����Cu�����ɵ�ͭ������п���棬��ϡ������Һ�й���ԭ��أ��ӿ�пʧ���ӡ����Ǽ��������ͭ���࣬���ɵ�ͭ�Ḳ����п���棬��ֹп��ϡ�����һ����Ӧ���������������ʻ������
����ʵ��������ݿ����ǡ���Ӧ��������Ҫ��ʱ�䡱����ͬ�����²������������������Ҫ��ʱ�䡱��ʵ������ʵ��������̽�������Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣
��ʵ������ʵ�������������ͭ��������ͬ������̽����������ͭ�����뷴Ӧ���ʵĹ�ϵ��
��2��ʵ���Ŀ����̽��K2S2O8��Һ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ӧ��֤ÿ��ʵ�����������ʵ�Ũ����ȣ�����Һ����������(��Ϊ20.0 mL)���Ӷ���֪Vx��2.0 mL��


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ձ���������������ƿ�������������Թܡ�����ƿ�����������þƾ��Ƽ���ʱ����Ҫ��ʯ��������
A. �ڢܢ� B. �٢ޢ�
C. �ۢܢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о���ѧ��Ӧ����Ҫ���塣
(1)���������У�SO2����������SO3��2SO2(g)��O2(g)![]() 2SO3(g)�������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ��ͼ1��ʾ(�������κ�һ�㶼��ʾƽ��״̬)��
2SO3(g)�������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ��ͼ1��ʾ(�������κ�һ�㶼��ʾƽ��״̬)��

�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ��________(��������ҡ�����)�ƶ���
������Ӧ���е�״̬Dʱ��v��________(�>����<������)v����
(2)�α�����ܵĺϳɰ������й�������N2(g)��3H2(g)![]() 2NH3(g) ��H<0��Ӧ�ô˷���Ӧ�ﵽƽ��ʱ��Ӧ���ת���ʲ��ߡ�
2NH3(g) ��H<0��Ӧ�ô˷���Ӧ�ﵽƽ��ʱ��Ӧ���ת���ʲ��ߡ�
����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ��Ĵ�ʩ��________(����)��
A��ʹ�ø���Ч�Ĵ���
B�������¶�
C����ʱ���������
D�����뵪������������Ũ��(���������������)
������ij�¶��£�2 L���ܱ������з����ϳɰ��ķ�Ӧ��ͼ2��ʾN2�����ʵ�����ʱ��ı仯���ߡ���H2��ʾ0��10 min�ڸ÷�Ӧ��ƽ������v(H2)��________���ӵ�11 min��ѹ�����������Ϊ1 L����n(N2)�ı仯����Ϊ________(����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. �ȼҵ�е�ⱥ��ʳ��ˮ��2Cl��+2H2O![]() H2��+Cl2��+2OH��
H2��+Cl2��+2OH��
B. �Ȼ�����Һ��ʴͭ�壺Fe3++Cu=Fe2++Cu2+
C. ����������Һ����������������SO2+OH��=HSO3��
D. ϡ�����м�����������Һ�����ԣ�Ba2++H++OH��+SO42��=BaSO4��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.�����¶ȿɽ��ͻ��
B.�ϵ������գ���Ҫ��Ҫ���õ����ǵĽ�������
C.�Ҵ������Ͷ��ǿ�������Դ��Ӧ�����ƹ����Ҵ�������
D.�ƹ�ʹ��̫���ܡ����ܡ������ܡ����ܣ������ڻ�������ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����Ĺ�ҵ�Ʒ��У���ȷ���ǣ� ��
A.���ƣ��ú�ˮΪԭ���Ƶþ��Σ��ٵ�ⴿ����NaCl��Һ
B.������������ʯΪԭ�ϣ�CO��ԭ����
C.��þ���ú�ˮΪԭ�ϣ���һϵ�й����Ƶ�����þ���壬H2��ԭ��þ
D.���������������л���������ٵõ��Ȼ������壬������ڵ��Ȼ����õ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 1mol�κ�����������Ϊ22.4 L
B. 1 mol�κ������ڱ�״������ռ�������Ϊ22.4 L
C. ��״���£�1 molˮ��ռ�������22.4 L
D. ��״���£�22.4 L���κ���������ʵ�������1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Լ��������ö������ױ������������������ۻ�ԭ�Ƶã�

��Ҫ��Ӧ��Ͳ�����������ʼ��±���
������ | ����״̬ | �ܽ��� | �۵㣨�棩 | �е㣨�棩 | �ܶȣ�g��cm-3�� |
�������ױ� | dz��ɫ���� | ������ˮ�������Ҵ����� | 51.4 | 237.7 | 1.286 |
�Լ����� | ��ɫƬ״���� | ����ˮ���������Ҵ����� | 43~45 | 200~202 | 1.046 |
�Լ����������� | ��ɫ���� | ������ˮ���������Ҵ����� | 243~245 | ���� | ���� |
�� | ��ɫҺ�� | ������ˮ�������Ҵ� | 5.5 | 80.1 | 0.874 |
ʵ���������£�

��ش��������⣺
��1����Ӧװ����ͼ��a��ȱ��һװ��_____________(����������)
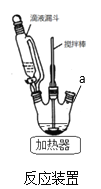
��2��������мӱ���������_____________�����������5%̼������Һ��pH=7~8��ԭ��_________
��3������۵õ��Ĺ�������Ϊ_________
��4���������������������_____________
��5���������ͨ����������������Һʹ�Լ������ᾧ������ԭ��Ϊ_____________
��6
A. ����ˮ B���Ҵ� C��NaOH��Һ D��HCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У��÷�Һ©�����ܷ�����ǣ� ��
A.����ˮB.����������ˮC.������Ҵ�D.��������ˮ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com