
分析 (1)随着反应的进行,硝酸的物质的量浓度降低,反应生成的气体颜色也变浅,发生Cu+4HNO3═Cu(NO3)2+NO2↑+2H2O、3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O;
(2)由于反应前后铜原子守恒,所以硝酸铜的物质的量即为铜的物质的量;
(3)根据铜的量计算转移电子的物质的量,以此可计算消耗氧气的物质的量,进而计算体积.
解答 解:(1)随着反应的进行,硝酸的物质的量浓度降低,反应生成的气体颜色也变浅,先发生Cu+4HNO3═Cu(NO3)2+NO2↑+2H2O,后发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
故答案为:Cu+4HNO3═Cu(NO3)2+NO2↑+2H2O、3Cu+8HNO3═Cu(NO3)2+2NO↑+4H2O;
(2)n(NO2)+n(NO)=$\frac{896×1{0}^{-3}L}{22.4L/mol}$=0.04mol,
即被还原的硝酸的物质的量为0.04mol,
n(Cu)=$\frac{2.56g}{64g/mol}$=0.04mol,则生成n(Cu(NO3)2)=0.04mol,
可知表现酸性的硝酸的物质的量为0.04mol×2=0.08mol,
则:参加反应的硝酸的物质的量为:0.04mol+0.08mol=0.12mol,
答:参加反应的硝酸的物质的量是0.12mol;
(3)n(Cu)=$\frac{2.56g}{64g/mol}$=0.04mol,转移0.08mol电子,将盛有生成气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,气体生成硝酸,
由HNO3$\stackrel{Cu}{→}$(NO2、NO)$\stackrel{O_{2}}{→}$HNO3可知,反应消耗氧气的物质的量为$\frac{0.08mol}{4}$=0.02mol,则体积为0.02mol×22.4L/mol=0.448L=448mL,
答;通入O2的体积为448mL.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析、计算及应用能力的考查,注意电子守恒、原子守恒的应用,题目难度不大.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题

| A. | 和氢气发生加成时大π键⑧断裂 | B. | 和金属钠反应时键⑦断裂 | ||
| C. | 和饱和溴水反应时键①、③、⑤断裂 | D. | 制备酚醛树脂时键②、⑥断键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
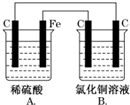 烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )| A. | A烧杯中电解质溶液pH变大 | |
| B. | B烧杯中阳离子从左向右移动 | |
| C. | 当A烧杯中产生0.1 mol气体时,B烧杯中产生气体为0.1 mol | |
| D. | 一段时间后,B烧杯中溶液的浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 | B. | 0.5mol•L-1 | ||
| C. | 22.4mol•L-1 | D. | 缺少密度无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| KMnO4酸性溶液的浓度 (mol•L-1) | 溶液褪色所需时间 (min) | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液中滴入硝酸银溶液 | B. | 金属钠在氯气中燃烧生成氯化钠 | ||
| C. | 铁片置于硫酸铜溶液中 | D. | 氢氧化钠溶液与稀硫酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com