
X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20,下列判断正确的是
| W | X | Y |
| Z |
A. 四种元素的原子半径:rZ>rX>rY>rW
B. 四种元素形成的单质最多有6种
C. 四种元素均可与氢元素形成电子总数为18的分子
D. 四种元素中,Z的最高价氧化物对应的水化物酸性最强
科目:高中化学 来源: 题型:
元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数
占核外电子总数的3/4,W—、Z+、X+半径逐渐减小,化合物XW常温下为气体,Z是本周
期中除稀有气体元素外,原子半径最大的元素,据此回答下列问题:
(1)Z在元素周期表中的位置 ,工业上生产Z单质的化学方程式为
(2)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH
均大于7,组成元素的原子数目比均为1∶1∶1。若A能抑制水的电离,而B能促进水的电
离,则A、B的化学式分别为 、 。
(3)C是由上述四种元素的两种组成的相对分子质量为34的化合物,则C的电子式 。
(4)用B在碱性条件下可以处理CN—的工业废水,请将下列6种微粒:CN—、CO32—
N2、OH—、B的阴离子,W的阴离子,分别填入在下对应的横线上,组成一个配平的离子方程式: + + ═ + + + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH小于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出c(H+)是pH为3的硝酸中水电离出c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
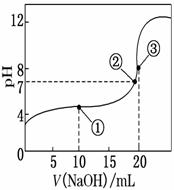
常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液,所得滴定曲线如图所示.下列说法正确的是( )
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
羟基磷灰石是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:在剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
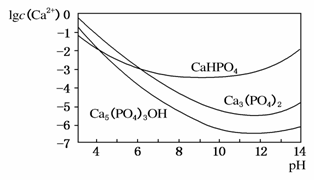
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O===Ca5(PO4)3OH↓+____ _ ___+___ _____。
②5Ca(OH)2+3H3PO4===__________________ ____________。
(2)与方法A相比,方法B的优点是___________ ____________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是_______________________________________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如
图所示。
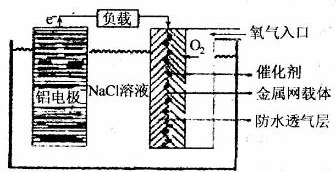
①该电池的总反应化学方程式为 ;
②电池中NaCl的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
检验淀粉、蛋白质、葡萄糖溶液,依次可分别使用的试剂和对应的现象正确的是( )
A.碘水,变蓝色 ;浓硝酸,变黄色 ;新制Cu(OH)2,砖红色沉淀
B.浓硝酸,变黄色 ;新制Cu(OH)2,砖红色沉淀;碘水,变蓝色
C.新制Cu(OH)2,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色
D.碘水,变蓝色 ;新制Cu(OH)2,砖红色沉淀;浓硝酸,变黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
以硫酸铜作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列叙述正确的是
①粗铜与直流电负极相连;
②阴极发生的反应为Cu2++2e-=Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
A.①③ B.②④ C.③④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com