
下列说法不正确的是( )
A. ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B. NH4HCO3(s) NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大。
B. 恒容容器中平衡体系A(g)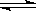 2B(g)中增加A的物质的量,A的转化率增大。
2B(g)中增加A的物质的量,A的转化率增大。
C. 一定条件下反应2AB(g) 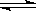 A2(g)+B2(g), 当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态。
A2(g)+B2(g), 当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态。
D. 已知反应A2(g)+2B2(g) 2AB2(g)△H <0, 升高温度,正向反应速率增加,逆向反应速率减小。
2AB2(g)△H <0, 升高温度,正向反应速率增加,逆向反应速率减小。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.将Na加入到CuSO4溶液中: 2Na+Cu2+=Cu+2Na+
B. 向Ca(OH)2溶液中通入过量CO2 : CO2 + OH- = HCO3-
C. 向H2SO4溶液加入Ba(OH)2溶液至中性: H++ SO42-+Ba2++OH-=BaSO4↓+ H2O
D. 向氯化铝溶液中加入足量氨水: Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,正确的是
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
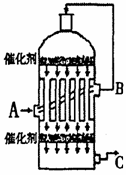 (1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为: ,该反应在 中进行(填仪器名称)。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为: ,该反应在 中进行(填仪器名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂
且有热交换器的 (填仪器名称)中进行反应。在如图所示的装置中, C处流出的气体有 ;SO3进入 (填仪器名称)用 吸收,得到浓硫酸或发烟硫酸。
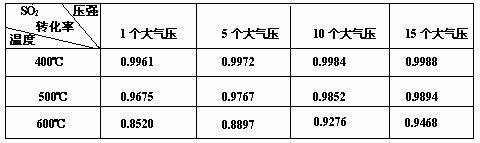
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下
表信息,结合工业生产实际,选择最合适的生产条件是 。
 |
(4)现在欲提高SO2的反应速率和转化率,下列措施可行的是 。
A、向装置中通入氮气且保持体积不变 B、向装置中通入氧气且保持体积不变
C、添加更多的催化剂 D、降低温度,及时转移SO3
(5)由吸收塔排出的尾气中有SO2的含量如果超过500μL/ L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是 ( )。
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是( )
A.充电时作阳极,放电时作正极
B.充电时发生还原反应,放电时发生氧化反应
C.充电时作阴极,放电时作负极
D.充电、放电时均发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,同一种物质既做氧化剂又做还原剂的是( )。
A.CaCO3 == CaO+CO2↑ B.Cu2(OH)2CO3 == 2CuO+H2O+CO2↑
C.Cl2+H2O==HCl+HClO D.2H2S+2O2 == SO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2 (该反应△H >0)
>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
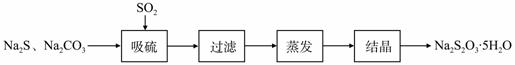
(1)吸硫装置如图所示。
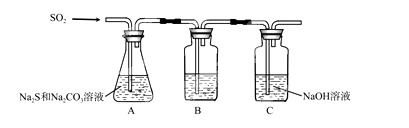
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O 2S2O32-+I2===S4O62-+2I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com