
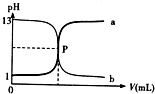
| A、P 点时反应恰好完全中和,溶液呈中性 |
| B、盐酸的物质的量浓度为1mol/L |
| C、曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D、酚酞不能用做本实验的指示剂 |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
| A、加入铝粉生成氢气的溶液中:MnO4-、C2O42-、Na+、K+ | ||
B、
| ||
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、I-、Br-、Ba2+ | ||
| D、已含Fe3+的溶液:K+、SCN-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) |
| B、中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C、0.2 mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D、已知难溶物FeS的Ksp=8.1×10-17,FeS饱和溶液中c(H+)2?c(S2-)=1.0×10-22,为使溶液里c(Fe2+)达到了1mol?L-1,应调节溶液中的c(H+)为1.11×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蒸发皿中放入NaCl溶液,加热、蒸发制取NaCl晶体 |
| B、用10ml的量筒量取5.2ml的盐酸 |
| C、用托盘天平称取25.2gNaCl |
| D、用50ml容量瓶配制100ml 0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 有关问题 |
| ①计算所需KCl的质量 | 需要称量KCl的质量为 |
| ②称量KCl固体 | 称量需要用到的主要仪器是: |
| ③将KCl加入100ml烧杯中,并加入适量水 | |
| ④将烧杯中溶液转移至500ml容量瓶中 | |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处应如何操作: |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 混合溶液 | A | B | C | D | E | F |
| 等浓度的稀草酸溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 4 |
| 实验序号 | 硫酸体积 | NaOH溶液体积 | NaOH溶液浓度 |
| ① | 5.00mL | 35.65mL | 5.00mol?L-1 |
| ② | 5.00mL | 39.65mL | 5.00mol?L-1 |
| ③ | 5.00mL | 35.55mL | 5.00mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅烷的分子通式可表示为SinH2n+2 |
| B、甲硅烷的稳定性比甲烷强 |
| C、甲硅烷的沸点高于甲烷 |
| D、甲硅烷燃烧生成SiO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
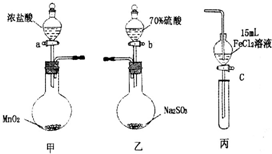 为验证氧化性C12>Fe3+>SO2某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性C12>Fe3+>SO2某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |||
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO
| ||
| Ⅱ | 有Fe3+无Fe2+ | 有SO
| ||
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com