

 .
.分析 P点代表氢元素,按照原子序数由小到大由里往外延伸,虚线连接的原子处于同族,由图可知,L为Na、M为Mg、X为Al、Y为P、K为O、Z为Cl.
(1)K元素是O元素,主族元素周期数=电子层数、族序数=最外层电子数;
(2)M是Mg元素、Z是Cl元素,二者通过得失电子生成离子化合物氯化镁;
(3)a.元素的非金属性越强,其气态氢化物越稳定;
b.虚线相连的元素处于同一族;
c.电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
d.由K、L两种元素组成的化合物可能是Na2O或Na2O2,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
(4)L是Na、Z是Cl元素,LZ溶液是NaCl溶液,中性条件下,铁发生吸氧腐蚀,Fe作负极、C作正极,正极上氧气得电子发生还原反应,若在图②溶液中滴加少量酚酞溶液并进行电解,发现Fe电极附近溶液变红,则Fe作阴极、C作阳极,阳极上氯离子放电生成氯气,牺牲阳极的阴极保护法利用的原理是原电池原理;
(5)室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3,向浓度均为0.1mol•L?1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,NaOH先和Fe(NO3)3反应生成Fe(OH)3,当铁离子完全反应后,Al(NO3)3再和NaOH反应生成Al(OH)3沉淀,Al元素完全以Al(OH)3形式存在时,如果继续滴加NaOH溶液,Al(OH)3转化为NaAlO2而消失,据此画出图象.
解答 解:P点代表氢元素,按照原子序数由小到大由里往外延伸,虚线连接的原子处于同族,由图可知,L为Na、M为Mg、X为Al、Y为P、K为O、Z为Cl.
(1)K元素是O元素,O原子核外有2个电子层、最外层电子数是6,所以O元素位于第二周期第VIA族,故答案为:第二周期第VIA族;
(2)M是Mg元素、Z是Cl元素,二者通过得失电子生成离子化合物氯化镁,其电子式为 ,故答案为:
,故答案为: ;
;
(3)a.元素的非金属性越强,其气态氢化物越稳定,非金属性Y<K,所以Y元素对应的氢化物不如K元素对应的氢化物更稳定,故错误;
b.虚线相连的元素处于同一族,且离中心越远,其原子半径越大,故正确;
c.电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径从小到大顺序为X3+<L+<K2?,故错误;
d.由K、L两种元素组成的化合物可能是Na2O或Na2O2,过氧化钠中存在离子键和共价键,故正确,
故选:bd;
(4)L是Na、Z是Cl元素,LZ溶液是NaCl溶液,中性条件下,铁发生吸氧腐蚀,Fe作负极、C作正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,若在图②溶液中滴加少量酚酞溶液并进行电解,发现Fe电极附近溶液变红,则Fe作阴极、C作阳极,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,牺牲阳极的阴极保护法利用的原理是原电池原理,
故答案为:O2+4e-+2H2O=4OH-;2Cl--2e-=Cl2↑;原电池;
(5)室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3,向浓度均为0.1mol•L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,NaOH先和Fe(NO3)3反应生成Fe(OH)3,当铁离子完全反应后,Al(NO3)3再和NaOH反应生成Al(OH)3沉淀,Al元素完全以Al(OH)3形式存在时,如果继续滴加NaOH溶液,Al(OH)3转化为NaAlO2而消失,所以滴加NaOH开始时没有氢氧化铝沉淀生成,当铁离子完全沉淀后再生成氢氧化铝沉淀,最后氢氧化铝完全溶解生成偏铝酸钠,因为硝酸铁和硝酸铝的浓度相等,则开始时不产生氢氧化铝沉淀、生成氢氧化铝沉淀、氢氧化铝沉淀完全溶解需要NaOH的体积之比为3:3:1,所以其图象为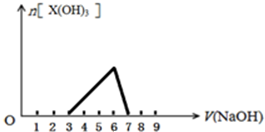 ,故答案为:
,故答案为: .
.
点评 本题考查元素周期表和元素周期律综合应用、电化学、溶度积、化学反应图象等,侧重考查学生分析问题、解决问题能力,(5)中作图注意根据方程式明确各阶段消耗氢氧化钠的体积关系,难度中等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 未冷却至室温直接把NaOH溶液移入容量瓶中 | |
| B. | 定容时观察液面仰视 | |
| C. | 样品中含有少量Na2O杂质 | |
| D. | 容量瓶中原来有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是一个物理量,是6.02×1023个粒子、 | |
| B. | 摩尔是物质质量的单位 | |
| C. | 摩尔是表示物质的量的单位 | |
| D. | 摩尔的标准是0.12kg12C中所含有的原子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的球棍模型: | B. | 聚氯乙烯的结构简式为CH2CHCl | ||
| C. | 3,3-二甲基-1-戊烯的键线式: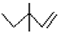 | D. | 乙醇分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液时使用的烧杯未洗涤 | B. | 定容时俯视读取刻度线 | ||
| C. | 原容量瓶洗净后未干燥 | D. | 转移时有少量溶液流出瓶外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | I | II | III |
| 实验 |  |  |  |
| 现象 | 有白色沉淀生成,滤液为蓝色 | 有白色沉淀生成,滴加稀硝酸,沉淀不溶解 | |
| 化学方程式 | 2AgNO3+CuCl2═2AgCl↓+Cu(NO3)2 | ||
| 离子方程式 | Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com