

 ,C物质中所含化学键类型离子键、非极性共价键.
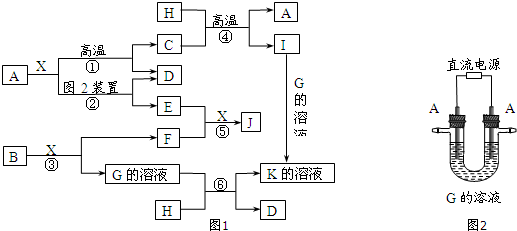
,C物质中所含化学键类型离子键、非极性共价键.分析 根据C为淡黄色固体且是化合物判断知,C是过氧化钠;过氧化钠和水反应生成氢氧化钠和氧气,F是单质且是气体,所以F是氧气,G是氢氧化钠;D为红棕色粉末,所以D是三氧化二铁;E是金属,E能和氢氧化钠溶液反应,所以E是铝,I是偏铝酸钠,J是氢气;D+E→A+B,A是金属,D是三氧化二铁、E是铝,所以A是铁,B是氧化铝;D和盐酸反应生成H,所以H是氯化铁;氯化铁和铁反应生成K,所以K 是氯化亚铁;氯化亚铁和氢氧化钠反应生成L,所以L 是氢氧化亚铁;氢氧化亚铁和氧气反应生成氢氧化铁,所以M是氢氧化铁,据此答题.
解答 解:C为淡黄色固体且是化合物判断知,C是过氧化钠;过氧化钠和水反应生成氢氧化钠和氧气,F是单质且是气体,所以F是氧气,G是氢氧化钠;D为红棕色粉末,所以D是三氧化二铁;E是金属,E能和氢氧化钠溶液反应,所以E是铝,I是偏铝酸钠,J是氢气;D+E→A+B,A是金属,D是三氧化二铁、E是铝,所以A是铁,B是氧化铝;D和盐酸反应生成H,所以H是氯化铁;氯化铁和铁反应生成K,所以K 是氯化亚铁;氯化亚铁和氢氧化钠反应生成L,所以L 是氢氧化亚铁;氢氧化亚铁和氧气反应生成氢氧化铁,所以M是氢氧化铁.
(1)C是过氧化钠,过氧根离子和钠离子之间存在离子键,氧原子和氧原子之间存在非极性共价键,所以C的电子式为 ,含有的化学键类型为离子键、非极性共价键,
,含有的化学键类型为离子键、非极性共价键,
故答案为: ;离子键、非极性共价键;
;离子键、非极性共价键;
(2)D、E反应为铝热反应,引发D、E反应的操作是加入适量 KClO3,插上镁条并将其点燃,化学反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:加入适量 KClO3,插上镁条并将其点燃;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)B是氧化铝,氧化铝是两性氧化物,既能和酸反应又能和强碱反应生成盐和水,反应①为氧化铝和氢氧化钠反应生成偏铝酸钠和水,该离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)反应②为氢氧化亚铁被氧气氧化的反应,反应的化学方程式为:4Fe(OH)2+O2+2 H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2 H2O=4Fe(OH)3;
(5)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,所以离子方程式为 2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(6)I是偏铝酸钠,偏铝酸是弱酸,是比碳酸还弱的酸,根据强酸制取弱酸,所以过量二氧化碳和偏铝酸钠能反应生成碳酸氢钠和氢氧化铝沉淀,反应方程式为CO2+2H2O+NaAlO2=Al(OH)3↓+NaHCO3,
故答案为:CO2+2H2O+NaAlO2=Al(OH)3↓+NaHCO3.
点评 本题以离子方程式和化学方程式的书写为载体考查了元素化合物的推断,难度不大,可根据物质的特殊颜色或特殊化学反应推断元素或化合物,注意“题眼”的确定,准确确定“题眼”是解推断题的关键.


科目:高中化学 来源: 题型:解答题
| 化学式 | 摩尔质量/(g•mol-1) | 质量/g | 物质的量/mol | 分子或离子数 |
| H2SO4 | 4.9 | |||
| SO2 | 0.5 | |||
| OH- | 6.02×1024 | |||
| NH4+ | 6.02×1022 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4HSO4]<c(NH4Cl) | |
| B. | 欲除去CuCl2溶液中混有少量的FeCl3,可加入CuO | |
| C. | 0.2mol/L HCl溶液与等体积0.05mol/L Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | 0.2mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 是酸性氧化物,不溶于水,也不能与任何酸发生反应 | |
| B. | Na2O、Na2O2组成元素虽然相同,但与H2O、CO2等反应的产物不完全相同 | |
| C. | CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在 | |
| D. | 浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的体积恒定不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的平均摩尔质量不变 | |
| D. | I2在混合气体中的体积分数与H2在混合气体中的体积分数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室中某些气体的制取、除杂及收集装置如图所示.仅用此装置和表中提供的物质完成相关实验,最合理的是( )
实验室中某些气体的制取、除杂及收集装置如图所示.仅用此装置和表中提供的物质完成相关实验,最合理的是( )| 选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
| A | 浓氨水 | CaO | 浓H2SO4 | NH3 |
| B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | Cl2 |
| C | 饱和食盐水 | Na2O2 | CuSO4溶液 | O2 |
| D | 浓硫酸 | Na2SO3 | 浓H2SO4 | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com