
| A. | 氯气溶于水:Cl2+H2O═Cl-+ClO-+2H+ | |
| B. | 金属钠加入稀硫酸中:Na+2H+═Na++H2↑ | |
| C. | 明矾溶液中加入足量Ba(OH)2溶液:SO42-+Al3++Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 向含有稀盐酸的氯化亚铁溶液中通入氧气:4Fe2++O2+4H+═4 Fe3++2H2O |
分析 A.次氯酸为弱酸,应保留化学式;
B.电荷不守恒;
C.离子个数配比不符合物质结构组成;
D.向含有稀盐酸的氯化亚铁溶液中通入氧气反应生成氯化铁和水.
解答 解:A.氯气溶于水,离子方程式:Cl2+H2O═Cl-+HClO-+H+,故A错误;
B.金属钠加入稀硫酸中,离子方程式:2Na+2H+═2Na++H2↑,故B错误;
C.明矾溶液中加入足量Ba(OH)2溶液,离子方程式:2SO42-+Al3++2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故C错误;
D.向含有稀盐酸的氯化亚铁溶液中通入氧气,离子方程式:4Fe2++O2+4H+═4 Fe3++2H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写、明确反应实质及离子方程式的书写方法是解题关键,注意反应物用量对反应的影响,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 已知2CO(g)+O2(g)=2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ | |
| C. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H═2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)$?_{500℃/30Mpa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是在反应②中既是氧化产物又是还原产物 | |
| B. | 氧化性强弱的顺序为:BrO3->ClO3->Cl2>Fe3+ | |
| C. | 溶液中可发生:ClO3-+6Fe2++6H+═Cl-+6Fe3++3H2O | |
| D. | Cl2在①、③反应中均作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 LCH3CH2OH中含有分子的数目为0.5NA | |
| B. | 58.5gNaCl晶体中含有NA个NaCl分子 | |
| C. | 56g铁粉与一定量氯化铁溶液反应生成0.75molFeCl2,失去的电子数为0.5 NA | |
| D. | 100mL浓度均为0.2mol/L的MgCl2和AlCl3混合溶液中阴离子的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为  | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为:  |
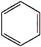 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )
我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源.其工作原理如图所示.下列有关说法不正确的是( )| A. | 电池工作时,电子的流向:锂电极→导线→碳电极 | |
| B. | 水既是氧化剂又是溶剂,有机电解质可用水溶液代替 | |
| C. | 电池总反应为2Li+2H2O=2LiOH+H2 | |
| D. | 该装置不仅可提供电能,还可得到清洁燃料氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下1molSO3的体积约为22.4L | |
| B. | pH小于7的雨水被称为酸雨 | |
| C. | 同温同压下,等质量的N2O4和NO2两种气体体积比为1:2 | |
| D. | 同温同压下,等质量的O2和SO2的所含原子个数比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com