
【题目】将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生如下反应,并达到平衡:H2(g)+I2(g)![]() 2HI(g)+Q(Q>0)。HI的体积分数HI%随时间变化如曲线(Ⅰ)所示,若改变反应条件,HI%的变化如曲线(Ⅱ)所示,则改变的条件可能是( )
2HI(g)+Q(Q>0)。HI的体积分数HI%随时间变化如曲线(Ⅰ)所示,若改变反应条件,HI%的变化如曲线(Ⅱ)所示,则改变的条件可能是( )
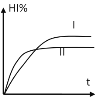
A.恒温条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
【答案】C
【解析】
该反应是反应前后气体体积不变的放热反应,曲线(Ⅱ)的拐点横坐标小于曲线(Ⅰ)的拐点横坐标,所以曲线(Ⅱ)的反应时间短,曲线(Ⅰ)的反应时间长,说明曲线(Ⅰ)的反应速率小于曲线(Ⅱ)的反应速率;曲线(Ⅱ)的拐点纵坐标小于曲线(Ⅰ)的拐点纵坐标,所以由曲线(Ⅰ)到曲线(Ⅱ),平衡向逆反应方向移动;
A.恒温条件下,加入适当催化剂,可加快反应速率,但化学平衡不移动,故A错误;
B.恒温条件下,缩小反应容器体积,即增大体系的压强,可加快反应速率,但化学平衡不移动,故B错误;
C.恒容条件下升高温度,温度升高,反应速率增大,平衡向逆反应方向移动,故C正确;
D.恒温条件下,扩大反应容器体积,减小体系的压强,反应速率降低,平衡不移动,故D错误;
故答案为C。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法合理的是( )
A.该滴定可用甲基橙作指示剂
B.Na2S2O3是该反应的还原剂
C.该滴定可选用如图所示装置

D.该反应中每消耗2 mol Na2S2O3,电子转移数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
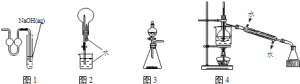
A.用图1装置作为制取二氧化碳的尾气吸收装置
B.用图2装置进行二氧化碳喷泉实验
C.用图3装置进行二氧化锰和浓盐酸制取氯气的实验
D.用图4装置进行石油的分馏实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g) ![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A.该反应的平衡常数表达式为K=![]()
B.平衡时c(CH3OH)=0.04 mol·L-1
C.该时刻正、逆反应速率的大小:v正<v逆
D.若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)Z(g)△H<0,一定温度下,在体积为2L的密闭容器中加入4mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列表述正确的是( )

A. 达到平衡时,X、Y、Z物质的量之比为1:2:1
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,X平衡转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+ ![]() O2(g) =CO2(g)+2H2O(g)ΔH=-a kJ/mol,则a___238.6(填“>”、“<”或“=”)。
O2(g) =CO2(g)+2H2O(g)ΔH=-a kJ/mol,则a___238.6(填“>”、“<”或“=”)。
(2)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过分析,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______、________。
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
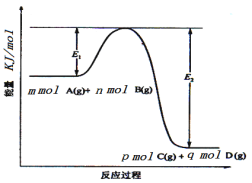
该反应ΔH=____kJ/mol(用含E1、E2式子表示);在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g) K,C(s)+CO2(g)
H2 (g) +CO2 (g) K,C(s)+CO2(g)![]() 2CO(g) K1,C(s) +H2O(g)
2CO(g) K1,C(s) +H2O(g)![]() CO(g) +H2(g) K2 ,则K、K1、K2之间的关系是 ___________。
CO(g) +H2(g) K2 ,则K、K1、K2之间的关系是 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图甲中阴影部分的面积表示v(正)与v (逆)的差值
B. 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO![]()
C. 图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图丁表示同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶的液体时,取下瓶塞倒立放桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子 ⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
A.①④⑦⑩B.②③④⑩C.⑤⑥⑦⑧D.①②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:FeO(s)+CO(g) = Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,请回答:
(1)判断化学反应进行的方向并计算反应物、生成物的平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com