
接触法制硫酸工艺中,其主反应在450 ℃并有催化剂存在下进行:
2SO2(g)+O2(g)2SO3(g) ΔH=-190 kJ/mol
(1)该反应所用的催化剂是________(填写化合物名称),该反应450 ℃时的平衡常数________500 ℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是___________________________________
___________________________________________________________________。
(3)下列说法能表明反应已达平衡状态的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=________mol·(L·min)-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
【解析】 此题考查了工业制硫酸、化学平衡常数、热化学方程式、化学平衡状态、有关化学平衡的计算等知识。
(1)工业制硫酸时二氧化硫催化氧化使用的催化剂是五氧化二钒;该反应正向放热,故温度越高化学平衡常数越小;
(2)热化学方程式表示的是450 ℃时,2 mol SO2气体和1 mol O2完全反应生成2 mol SO3气体时放出的热量为190 kJ;
(3)根据化学平衡状态的特征,容器中气体的平衡相对分子质量不随时间变化、分子总数不随时间变化时,说明反应达到平衡状态;
(4)当达到平衡时,容器中SO3的物质的量为0.18 mol,则v(SO3)=0.072 mol·(L·min)-1,则v(O2)=0.036 mol(L·min)-1;再继续通入0.20 mol SO2和0.10 mol O2时,平衡向正反应方向移动,在此达到平衡时,SO3的物质的量介于0.36 mol和0.40 mol之间。
【答案】 (1)五氧化二钒(V2O5) 大于
(2)在450 ℃时,2 mol SO2气体和1 mol O2气体完全反应生成2 mol SO3气体时放出的热量为190 kJ
(3)bd (4)0.036 向正反应方向 0.36 0.40


科目:高中化学 来源: 题型:
下列各项中,关于用途的说法不正确的是 ( )
A.75%(体积分数)的酒精溶液常用于医疗消毒
B.乙烯主要用于作燃料使用
C. 石油裂化的主要目的是为了得到轻质油
D.乙酸常用作调味剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )
A.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
B.增大压强可加快SO2转化为SO3的速率
C.黄绿色的氯水光照后颜色变浅
D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H(g)===2NH3(g) ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时有甲、乙两杯醋酸溶液,甲的pH=2,乙的pH=3,下列判断正确的是( )
A.甲中由水电离出来的H+的物质的量浓度是乙中由水电离出来的H+的物质的量浓度的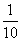
B.甲、乙两杯溶液的物质的量浓度之间的关系为c(甲)=10c(乙)
C.中和等物质的量的NaOH,需甲、乙两杯醋酸的体积(V)之间的关系为10V(甲)>V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程伴随的能量变化中,属于反应热的是( )
A.形成1 mol H—Cl键放出的能量
B.石墨转变成金刚石吸收的能量
C.1 mol O2形成2 mol O原子吸收的能量
D.水蒸气变成液态水放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述不正确的是( )
A.该温度高于25 ℃
B.由水电离出来的H+的浓度是1.0×10-12 mol·L-1
C.加入NaHSO4晶体抑制了水的电离
D.c(H+)=c(OH-)+c(SO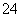 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是( )
甲:在500 ℃时,10 mol SO2和6 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和5 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,电解较稀浓度的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为3H2O+3O2===O3+3H2O2。下列有关说法正确的是( )
A.电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-===O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-===H2O2+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com