
| A�� | Cu��Cu2S�����ʵ���֮��Ϊ10��1 | |
| B�� | ��������ʵ���Ũ��Ϊ1.2mol/L | |
| C�� | Cu��OH��2��������Ϊ29.4g | |
| D�� | Cu��CuS�����ᷴӦ��ʣ��HNO3Ϊ0.4mol |
���� ��������Һ�м���1.0mol/L ��NaOH��Һ1.0L����ʱ��Һ�����ԣ�������������ȫ��������Һ������ΪNaNO3��n��NaNO3��=n��NaOH��=1.0mol/L��1.0L=1mol������ΪCu��OH��2������������ȫ��Ӧ������S���ʡ�Cu��NO3��2�ͱ�״����4.48LNO��n��NO��=$\frac{4.48L}{22.4L/mol}$=0.2mol�����������ԭ��Ӧ�����غ���ʽ���㣬��20.0gCu ��Cu2S�Ļ������ͭ���ʵ���Ϊx��������ͭ���ʵ���Ϊy��
Cu��Cu2+��2e-
x 2x
Cu2S��2Cu2+��2e-
y 2y
Cu2S��S��2e-
y 2y
HNO3��NO��3e-
1 3
0.2mol 0.6mol
��64x+160y=20.0
2x+2y+2y=0.6mol
x=0.25mol
y=0.025mol
����ͭԪ���غ���n��Cu��+2n��Cu2O��=n[Cu��OH��2]�����Է�Ӧ�����Һ��n[[Cu��NO3��2]=n[Cu��OH��2]=0.3mol���ʷ�Ӧ��������ʣ�࣬�ݴ˷�������ѡ���жϣ�
��� �⣺��������Һ�м���1.0mol/L ��NaOH��Һ1.0L����ʱ��Һ�����ԣ�������������ȫ��������Һ������ΪNaNO3��n��NaNO3��=n��NaOH��=1.0mol/L��1.0L=1mol������ΪCu��OH��2������������ȫ��Ӧ������S���ʡ�Cu��NO3��2�ͱ�״����4.48LNO��n��NO��=$\frac{4.48L}{22.4L/mol}$=0.2mol�����������ԭ��Ӧ�����غ���ʽ���㣬��20.0gCu ��Cu2S�Ļ������ͭ���ʵ���Ϊx��������ͭ���ʵ���Ϊy��
Cu��Cu2+��2e-
x 2x
Cu2S��2Cu2+��2e-
y 2y
Cu2S��S��2e-
y 2y
HNO3��NO��3e-
1 3
0.2mol 0.6mol
��64x+160y=20.0
2x+2y+2y=0.6mol
x=0.25mol
y=0.025mol
����ͭԪ���غ���n��Cu��+2n��Cu2O��=n[Cu��OH��2]�����Է�Ӧ�����Һ��n[[Cu��NO3��2]=n[Cu��OH��2]=0.3mol���ʷ�Ӧ��������ʣ�࣬
A��Cu��Cu2S�����ʵ���֮��=0.25��0.025=10��1����A��ȷ��
B�����ݼ����֪����Ӧ��������������ͭ��һ��������ʣ������ᣬӦΪ1mol+0.2mol=1.2mol��Ũ��=$\frac{1.2mol}{0.5L}$=2.4mol/L����B����
C��Cu��OH��2��������=98g/mol��0.3mol=29.4g����C��ȷ��
D��Cu��CuS�����ᷴӦ��ʣ��HNO3=1mol+0.2mol-0.6mol-0.2mol=0.4mol����D��ȷ��
��ѡB��
���� ���⿼����������ԭ��Ӧ�ļ����������Ҫ��Ԫ���غ㡢�����غ�ļ���Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶��X��Y��Z��W | |
| B�� | X��Y��Z����Ԫ�ص�����������ˮ��������֮�������Ӧ | |
| C�� | X��Y��Ӧ���Ȼ��ﶼ�����Ӿ��� | |
| D�� | W������⻯��е��Z�ĸ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������C | B�� | �����ݻ�����Сѹǿ | ||
| C�� | ��С�ݻ�������ѹǿ | D�� | �ݻ����䣬���롰�衱�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
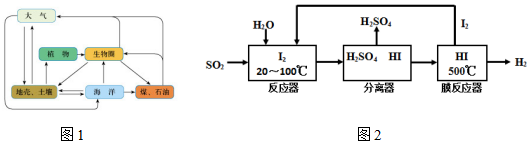

ѹǿ �¶ȡ� | 0.2Mpa | 1.0Mp | 10Mpa |
| 400 | 97.2% | 99.5% | 99.7% |
| 500 | 91.5% | 96.9% | 97.8% |
| 600 | 72.6% | 85.8% | 89.5% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ݶԽ��߹�������������ʾ��������� | |
| B�� | ��H3O+��NH4+��[Cu��NH3��4]2+�ж�������λ�� | |
| C�� | O3��SO2�Ľṹ���� | |
| D�� | P4��CH4����������������Ҽ��Ƕ�Ϊ109��28�@ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȫ��������������ɫ��Դ | B�� | ÿ��N5+�к���35������ | ||
| C�� | ÿ��N5-�к���35������ | D�� | N5+N5-�ṹ�к����ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ������ | ʵ��Ŀ�� |
| A | ��ע�����ռ�ͭ��Ũ���ᷴӦ���ɵ����壬Ȼ������ע���� | �о�ѹǿ�Ի�ѧƽ���ƶ���Ӱ�� |
| B | ��ʵ�����Ƶõ����������м��뱥��̼������Һ��Ȼ������ | ��ȥ���������л��е����ᡢ�Ҵ� |
| C | �ñ���FeCl3��Һ�Ƶ�Fe��OH��3���壬Ȼ����� | �ᴿFe ��OH��3���� |
| D | ������FeCl2��CuCl2��Һ�м���H2O2���ð�ˮ����pH ��2.7 ����� | ��ȥCuCl2��Һ��FeCl2���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���������� | ���� |
| A | ��������ˮ����KI��Һ�У���ַ�Ӧ���ټ���CCl4�������ã��²�Һ�����ɫ | �����ԣ�Br2��I2 |
| B | �����£���ĥ�����Ƭ����HNO3�У����������� | �����£�������ŨHNO3��Ӧ |
| C | ��һ����AgNO3��Һ�У��ȵμ�KCl��Һ���ٵμ�KI��Һ���ȳ��ְ�ɫ����������ֻ�ɫ���� | Ksp��AgCl����Ksp��AgI�� |
| D | ��pH�ƲⶨNaF��Һ��CH3COONa��Һ��֪��pH��NaF����pH��CH3COONa�� | ���ԣ�HF��CH3COOH |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
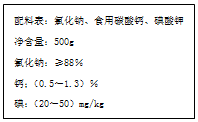 ��ͼ��ij��������ij�ּӸ�ʳ�ΰ�װ��ǩ�ϵIJ������֣����Ķ���ش��������⣺
��ͼ��ij��������ij�ּӸ�ʳ�ΰ�װ��ǩ�ϵIJ������֣����Ķ���ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com