
| A. | 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构 | |
| B. | 高聚物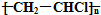 的单体可以通过乙烯和HCl加成制得 的单体可以通过乙烯和HCl加成制得 | |
| C. | (CH3)2CH-CH=CH-C(CH3)3与氢气加成后的产物用系统命名法命名为2,2,5-三甲基己烷 | |
| D. | 完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同 |
分析 A.对二甲苯只有一种结构,无法判断是否存在C-C单键与C=C双键的交替结构;
B.乙烯和HCl加成制得的是一氯乙烷,不存在碳碳双键,不能进行加聚反应;
C. (CH3)2CH-CH=CH-C(CH3)3与氢气加成后的产物为(CH3)2CHCH2CH2C(CH3)3,根据烷烃的命名方法命名;
D.冰醋酸与葡萄糖的最简式相同,据此解答即可.
解答 解:A.邻二甲苯只有一种结构,说明苯中不存在单双键交替的结构,是一种特殊的化学键,故A正确;
B.此高聚物是由乙炔与HCl加成生成的产物加聚得来的,故B错误;
C.(CH3)2CH-CH=CH-C(CH3)3与氢气加成后的产物为(CH3)2CHCH2CH2C(CH3)3,应命名为2,2,5-三甲基己烷,故C正确;
D.冰醋酸与葡萄糖的最简式相同,均是CH2O,故完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同,故D正确,故选B.
点评 本题主要考查的是烯烃的命名、苯的结构以及烃的衍生物的燃烧规律,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
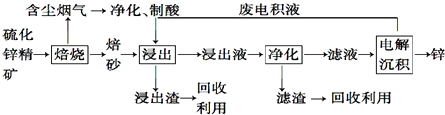
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
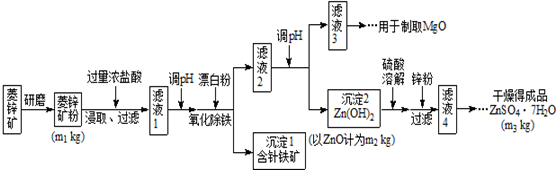
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | s轨道与s轨道之间可以在任何方向上成键,所以共价键都没有方向性 | |
| D. | s轨道与p轨道只有沿着一定的方向,才能发生最大程度的重叠,形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
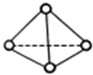 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )| A. | 1molN4气体转化为N2时要吸收206 kJ能量 | |
| B. | N4是一种比N2更稳定的分子 | |
| C. | 1molN4气体转化为N2时要放出740 kJ能量 | |
| D. | N4与N2之间不是同素异形体关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| B. | 构成单质分子的粒子之间不一定存在共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 阴、阳离子间通过离子键一定能形成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com