
【题目】(2015·江苏化学,14,4分)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10 mol·L-1 NH4HCO3溶液中通CO2:c(NH![]() )=c(HCO
)=c(HCO![]() )+c(CO
)+c(CO![]() )
)
B.向0.10 mol·L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH![]() )>c(SO
)>c(SO![]() )
)
C.向0.10 mol·L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)]
)+c(H2SO3)]
D.向0.10 mol·L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-)
【答案】D
【解析】A、两者不反应,根据溶液呈现电中性,c(NH4+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),因为pH=7,c(H+)=c(OH-),即c(NH4+)=c(HCO3-)+2c(CO32-),故错误;B、HSO3-![]() H++SO32-,NH3和H+反应,生成亚硫酸钠和亚硫酸铵,水解的程度是微弱的,c(Na+)>c(SO32-)=c(NH4+),故错误;C、Na2SO3+SO2+H2O=2NaHSO3,pH=7,反应后溶液的溶质Na2SO3、NaHSO3,根据物料守恒:2c(Na+)=3[c(SO32-)+c(HSO3-)+c(H2SO3)],故错误;D、CH3COONa+HCl=CH3COOH+NaCl,溶液pH=7,反应后的溶质:NaCl、CH3COOH、CH3COONa,电离和水解相等,即:c(Na+)>c(CH3COOH)=c(Cl-),故正确。
H++SO32-,NH3和H+反应,生成亚硫酸钠和亚硫酸铵,水解的程度是微弱的,c(Na+)>c(SO32-)=c(NH4+),故错误;C、Na2SO3+SO2+H2O=2NaHSO3,pH=7,反应后溶液的溶质Na2SO3、NaHSO3,根据物料守恒:2c(Na+)=3[c(SO32-)+c(HSO3-)+c(H2SO3)],故错误;D、CH3COONa+HCl=CH3COOH+NaCl,溶液pH=7,反应后的溶质:NaCl、CH3COOH、CH3COONa,电离和水解相等,即:c(Na+)>c(CH3COOH)=c(Cl-),故正确。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:
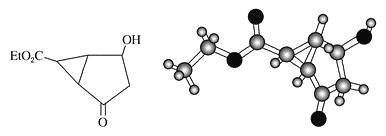
该有机分子的核磁共振氢谱图如下(单位是ppm)。
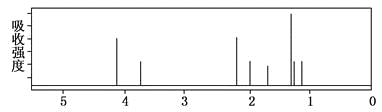
下列关于该有机物的叙述不正确的是
A. 该有机物不同化学环境的氢原子有8种
B. 该有机物与氢氧化钠的醇溶液共热时可以发生消去反应
C. 键线式中的Et代表的基团为—CH2CH3
D. 1mol该有机物最多可以与2mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【全国校级联考.2017届浙江省稽阳联谊学校高三3月选考】常温下,0.2 moI·L-l的Na2CO3溶液与0.2 moI·L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是
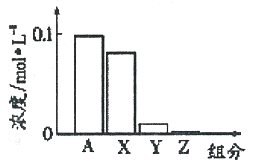
A. A代表Na+浓度
B. 该溶液中c(OH-)>c(Y)
C. 向该溶液中加水稀释,所有离子浓度均减小
D. 该混合溶液中:c(X)+c(Y)+c(Z)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C和D是同一周期的四种元素,A、B、C的原子序数依次相差1;A元素的单质化学性质最活泼,能与水直接发生反应.B元素的氧化物2.0g恰好跟100mL0.5mol/L的H2SO4完全反应.B元素的单质跟D元素单质反应生成BD2型化合物.根据以上事实回答:
(1)A原子的结构示意图为
(2)C在周期表中的位置:
(3)BD2含有的化学键类型为
(4)A、C两元素最高价氧化物的水化物相互反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物,不能用分液漏斗分开的是:①四氯化碳、水 ②乙醇、甘油 ③ 乙醇、水 ④苯、水 ⑤己烷、水 ⑥环己烷、苯 ⑦溴苯、水
A.②③⑥ B.①②③ C.①④⑤⑦ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl===NaCl+H2O;B.Zn+H2SO4===ZnSO4+H2↑。
判断能否设计成原电池A__________,B__________(填“能”或“不能”)。
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
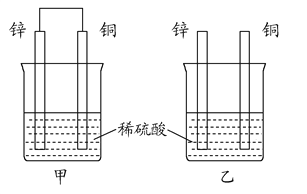
①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲__________乙(填“>”、“<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.7 kJmol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:( )
CH3OH(g) △H1=-90.7 kJmol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:( )
A.该反应属于熵增放热反应,一定能自发进行
B.5 min内H2的平均反应速率为0.1 mol/(L·min)
C.若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4
D.其它条件不变的情况下,加入催化剂可提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关丙烯酸(CH2=CHCOOH)的说法正确的是
A. 丙烯酸使溴水褪色属于氧化反应
B. 丙烯酸能发生加成反应但不能发生取代反应
C. 丙烯酸分子中所有碳原子不可能处于同一平面
D. 反应 CH2=CHCOOH+H2![]() CH3CH2COOH的原子利用率为100%
CH3CH2COOH的原子利用率为100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com