
| A、Mg和Al |
| B、Mg和Zn |
| C、Fe和Zn |
| D、Cu和Fe |
. |
| M |
| m总 |
| n总 |
| 11.2L |
| 22.4L/mol |
| 13 |
| 0.5 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
| A、氯碱工业中通常使用阳离子交换膜将电解池的阳极区与阴极区隔开 | ||||
| B、合成氨工业中,将NH3不断液化分离有利于加快反应速率 | ||||
| C、在铜质餐具上镀银时,应将餐具与电源的正极相连 | ||||
D、高炉炼铁的主要反应为:Fe2O3+3CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
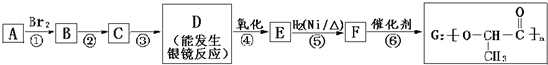

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验Ⅰ:除去Cl2中混有的HCl气体 |
| B、实验Ⅱ:溶液颜色变红 |
| C、实验Ⅲ:放出大量气体 |
| D、实验Ⅳ:先出现白色沉淀,后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g |
| B、3.36g |
| C、5.60g |
| D、10.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、②③④⑤ |
| C、①③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 分散系的分类 |
B、 醋酸稀释 |
C、 向Na2CO3溶液中逐滴滴入盐酸 |
D、 向AlCl3溶液中滴加过量的NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com