
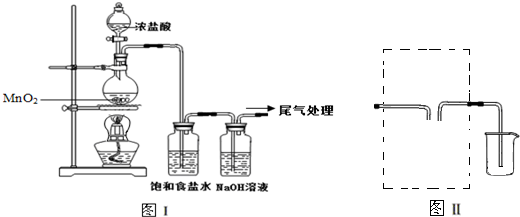
| ||
| ||
 ,故答案为:
,故答案为: ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、通常状况CH4和H2O间一般不形成氢键 |
| B、CH4和H2O都是非极性分子 |
| C、甲烷与水分子间可形成氢键 |
| D、“可燃冰”是一种洁净能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料.如LiFePO4电池中某电极的工作原理如图:
(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料.如LiFePO4电池中某电极的工作原理如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 举例反应 | mA(g)+nB(g)?pC(g)+qD(g) | 平衡是否建立 | ||||
| 混合物体系中各成分的含量 | ①各物质的物质的量或各物质的物质的量分数一定 | |||||
| ②各物质的质量或各物质的质量分数一定 | ||||||
| ③各气体的体积或体积分数一定 | ||||||
| ④总压强、总体积、总物质的量一定(m+n和p+q的关系不定) | ||||||
| 正、逆反应速率的关系 | ①在单位时间内消耗了m molA同时生成m molA | |||||
| ②在单位时间内消耗了n molB同时生成p molC | ||||||
| ③vA:vB:vC:vD=m:n:p:q | ||||||
| ④在单位时间内生成了n molB,同时消耗q molD | ||||||
| 压强 | ①m+n≠p+q时,总压力一定(其他条件一定) | |||||
| ②m+n=p+q时,总压力一定(其他条件一定) | ||||||
混合气的平均相对分子量
| ①
| |||||
②
| ||||||
| 温度 | 在其他条件不变的条件下,体系温度一定时 | |||||
| 体系的密度 | 密度一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成水的氢和氧都是可燃物,因此可研究在水不分解情况下,使氢成为二级能源 |
| B、设法将太阳光聚焦,产生高温,使水分解产生氢气 |
| C、寻找高效催化剂,使水分解产生氢气,同时吸收能量 |
| D、寻找特殊催化剂,利用太阳光或其它方式分解水制取氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com