
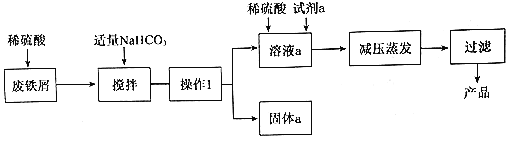
【题目】碱式硫酸铁[Fe(OH)SO4]是重要的化工原料,工业上利用废铁屑(含少量氧化铝、 氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:Ksp[Fe(OH)3]=2.6×10-39 Ksp[Fe(OH)2]=4.9×10-17 Ksp[Al(OH)3]=8×10-32(单位略)
(1)工业生产中,常将废铁块处理为废铁屑,其目的是_______;用稀硫酸处理废铁屑的过程中______个氧化还原反应发生。
(2)加入碳酸氢钠后,发生反应的主要离子方程式为_______。
(3)若要使沉淀完全(一般认为离子浓度小于10-5 molL-1即为沉淀完全),溶液的pH为________;此溶液中亚铁离子的物质的量浓度不高于_____molL-1才不会生成沉淀。
(4)从环保、产品纯度角度分析.试剂a最好选择下列物质中的_____(填字母代号)。
A NaClO B KNO3 C H2O2 D KMnO4
(5)若搅拌过程中NaHCO3过量,会产生FeCO3沉淀和大量气泡,若将NaHCO3改为 Na2CO3过量时产生的沉淀为FeCO3和Fe(OH)2的混合物,试解释混合物中有Fe(OH)2的原因___。
【答案】增大表面积,加快反应速率 2 Al3++3HCO3-=Al(OH)3↓+3CO2↑ 5.3 12.25 C 改为Na2CO3以后,由于Na2CO3溶液的碱性(或水解程度)比NaHCO3溶液的强,所以会生成Fe(OH)2
【解析】
废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,反应后加入NaHCO3并搅拌,调节溶液的pH,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑,所以固体a成分是Al(OH)3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和氧化剂,酸性条件下,发生氧化还原反应生成铁离子,将溶液蒸发浓缩、过滤得到碱式硫酸铁,以此解答该题。
(1)将废铁块处理为废铁屑,固体表面积增大,可加快反应速率,涉及反应为Fe+H2SO4=FeSO4+H2↑、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,有2个属于氧化还原反应,即Fe+H2SO4=FeSO4+H2↑、Fe2(SO4)3+Fe=3FeSO4;
(2)反应后加入NaHCO3并搅拌,调节溶液的pH,碳酸氢根和铝离子双水解,发生反应Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)若要使A13+沉淀完全,Ksp[Al(OH)3]=c(Al3+)·c3(OH-)=8×10-32,当c(Al3+)=10-5 molL-1时c(OH-)=![]() mol/L=2×10-9mol/L,c(H+)=5×10-6mol/L,pH=5.3;根据Ksp[Fe(OH)2]= c(Fe2+)·c2(OH-)=4.9×10-17可知,此溶液中亚铁离子的物质的量浓度不高于
mol/L=2×10-9mol/L,c(H+)=5×10-6mol/L,pH=5.3;根据Ksp[Fe(OH)2]= c(Fe2+)·c2(OH-)=4.9×10-17可知,此溶液中亚铁离子的物质的量浓度不高于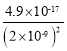 =12.25mol/L;
=12.25mol/L;
(4)从环保、产品纯度角度分析,试剂a最好选择过氧化氢即C选项,可避免生成杂质或污染性气体;
(5)由于碳酸钠水解程度比碳酸氢钠大,溶液碱性较强,因此会生成Fe(OH)2。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)可用作抗氧剂等,工业上常用尿素[CO(NH2)2]和 NaClO溶液反应制备水合肼。
已知:Ⅰ.N2H4·H2O 的结构如图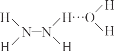 (…表示氢键)。
(…表示氢键)。
Ⅱ.N2H4·H2O 沸点 118 ℃,具有强还原性。
(1)将 Cl2 通入过量 NaOH 溶液中制备 NaClO,得到溶液 X,离子方程式是__。
(2)制备水合肼:将溶液 X 滴入尿素水溶液中,控制一定温度,装置如图 a(夹持及控温装置已略)。充分反应后,A 中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品 NaCl 和Na2CO3·10H2O。

①A 中反应的化学方程式是__。
②冷凝管的作用是__。
③若滴加 NaClO 溶液的速度较快时,水合肼的产率会下降,原因是__。
④NaCl 和 Na2CO3 的溶解度曲线如图 b。由蒸馏后的剩余溶液获得 NaCl 粗品的操作是__。
(3)水合肼在溶液中可发生类似 NH3·H2O 的电离,呈弱碱性;其分子中与 N 原子相连的 H 原子易发生取代反应。
①水合肼和盐酸按物质的量之比 1∶1 反应的离子方程式是__。
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与 DEC( ![]() )发生取代反应制得。碳酰肼的结构简式是__。
)发生取代反应制得。碳酰肼的结构简式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_________________________。
(2)乙池中C(石墨)电极的名称为____(填“正极”“负极”或“阴极”“阳极”),总反应的化学方程式为_________________________。
(3)当乙池中D极质量增加5.4g时,甲池中理论上消耗O2的体积为_____mL(标准状况),转移的电子数为__________
(4)丙池中_____(填“E”或“F”)极析出铜。
(5)若丙中电极不变,将其溶液换成NaCl溶液,开关闭合一段时间后,丙中溶液的pH将_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下能大量共存的是( )
A.由水电离产生的c(H+)=1×10-10molL-1的溶液中:NO3-、Fe2+、Na+、SO42-
B.![]() =10-10molL-1的溶液中:NH4+、I-、Cl-、K+
=10-10molL-1的溶液中:NH4+、I-、Cl-、K+
C.![]() =1×106的溶液中:K+、Na+、Cl-、HCO3-
=1×106的溶液中:K+、Na+、Cl-、HCO3-
D.惰性电极电解AgNO3后的溶液中:SO32-、K+、Na+、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)如图是自来水表的常见安装方式,发生腐蚀过程中,电流从___(填“接头流向水表”或“水表流向接头”)。

(2)某二次电池放电的电池反应为2Fe+O2+2H2O=2Fe(OH)2。反应结束时,电池的负极的质量___(“减小”“不变”或“增加”),该电池的正极反应式为___。
(3)有如图装置:
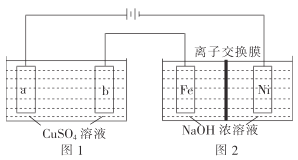
①图1中,用惰性电极电解过程中的实验数据如图,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中图1装置中产生气体的总体积(标准状况)。电解过程中转移n(e-)=0.4mol,b电极的实验现象为___;Q点时,a电极收集到的气体体积为___。
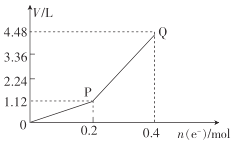
②图2中,装置通电后,溶液仍然保持澄清,铁电极附近呈紫红色(已知FeO42-在水溶液中呈紫红色),Fe电极上发生的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。下列说法错误的是( )
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是( )
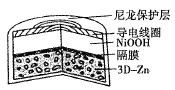
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电时正极反应为NiOOH(s)+H2O(l)+e-=Ni(OH)2(s)+OH-(aq)
C.放电时负极反应为Zn(s)+2OH-(aq)-2e-=ZnO(s)+H2O(l)
D.放电过程中OH-通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NCl3是一种黄色粘稠状液体,常用干杀菌消毒,工业上通过情性电极电解氯化铵和盐酸的方法制备NCl3,其原理如图所示。下列说法正确的是
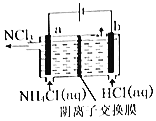
A.在b极区产生的气体是H2
B.a极的电极反应式为NH4+-6e-+ 4OH-+3Cl-=NCl3+4H2O
C.溶液中的Cl-移向a极区
D.若将阴离子交换膜改为阳离子交换膜,NH4Cl的利用率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铝片与Na2CO3溶液的反应:
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 H2和CO2) |
下列说法正确的是( )
A.Na2CO3溶液中存在水解平衡:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO2↑
C.对比Ⅰ、Ⅲ,说明 Na2CO3溶液能破坏铝表面的保护膜
D.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物R的结构简式如右图,下列有关R的说法正确的是
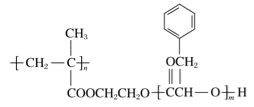
A. R的一种单体的分子式为C9H10O2
B. R完全水解后的生成物均为小分子有机物
C. 可以通过加聚反应和缩聚反应合成R
D. 碱性条件下,1 mol R完全水解消耗NaOH的物质的量为2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com