
| A. | 120.4g/mol | B. | 50.4g/mol | C. | 182.4g/mol | D. | 252g/mol |
分析 同温同压下气体的体积比等于物质的量之比,设A的物质的量为1mol,根据方程式可知生成的混合气体的物质的量为5mol,而5molH2的质量是10g,它的10倍是100g,和混合气体与固体B之间的关系,根据质量守恒来求解.
解答 解:同温同压下气体的体积比等于物质的量之比,设A的物质的量为1mol,根据方程式A(s)$\frac{\underline{\;\;△\;\;}}{\;}$B(s)+C(g)+4D(g),可知生成的混合气体的物质的量为5mol,而5molH2的质量是5mol×2g/mol=10g,它的10倍是100g,由方程式可知:
1molB~5mol的混合气体~1molA
5×22.4 1
22.4 n(A)
则:$\frac{5×22.4}{22.4}$所以:n(A)=0.2mol
又因为1molA得到混合气体100g,则0.2molA得到混合气体20g,由质量守恒可知:0.2molA的质量为20g+30.4g=50.4g,
所以M(A)=$\frac{50.4g}{0.2mol}$=252g•mol-1,
故选D.
点评 本题考查有关摩尔质量的相关计算,学生只要灵活运用质量守恒和关系式法就能迅速解题.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用含0.lmolFeCl3的溶液与足量沸水反应制得的Fe(0H)3胶体中胶粒数为0.1NA | |
| B. | 46g N02和N204的混合气体中含原子总数为NA | |
| C. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| D. | 0.25 mol Na2O2中含有的阴离子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原料无爆炸危险 | B. | 原料都是无毒物质 | ||
| C. | 没有副产物,原料利用率高 | D. | 对设备腐蚀性较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | II A | IIIA | IVA | VA | VIA | VⅡA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
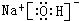 或
或 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
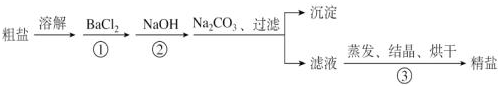
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2O | D. | NH3 H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 可能有乙烷 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com