
��ͬ�¶ȣ���ͬ���ʵ���Ũ�ȵ�������Һ���� CH3COONa �� NaHSO4 �� NaCl �� C6H5-ONa ��NaHCO3 ��Na2CO3 ����pH�ɴ�С��˳�����У���ȷ����
�� A�� ��>��>��>��>��>�ڡ� B�� ��>��>��>��>��>��
C�� ��>��>��>��>��>�� �� D�� ��>��>��>��>��>��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
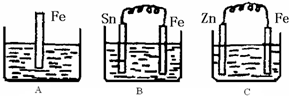
 2Z
2Z 2Z
2Z�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
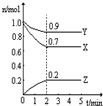
| 16 |
| 3 |
| ���� | ����1 | ����2 | ����3 |
| ��Ӧ��Ͷ������ʼ̬�� | 1molCO2��3molH2 | 0.5molCO2��1.5molH2 | 1molCH3OH��1molH2O |
| CH3OH��ƽ��Ũ��/mol?L-1 | c1 | c2 | c3 |
| ƽ��ʱ��ϵѹǿ/Pa | p1 | p2 | p3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�ݻ�Ϊ4 L���ܱ������У�����0.4mol��N2��1.2mol��H2����һ�������£��������·�Ӧ��
N2(g)��3H2(g)![]() 2NH3(g ) ��H��0 ��
2NH3(g ) ��H��0 ��
��Ӧ��NH3�����ʵ���Ũ�ȱ仯�������ͼ��
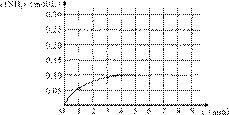
��1��������ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ
����Ӧ����v(NH3)Ϊ______mol/��L��min����
��2����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ___________��
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
��3����Ӧ�ﵽƽ���5����ĩ�����������������䣬��ֻ�������������Сһ�룬ƽ��___________________�ƶ�������淴Ӧ������������Ӧ����������
��4���ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱNH3��Ũ��ԼΪ0.25 mol/L����������ͼ�л�����5����ĩ����ƽ��ʱNH3Ũ�ȵı仯���ߡ�
��5����������ͬ�����и�����1 molN2��3molH2����ijһ��ͬ�����·�Ӧ���ﵽƽ�⣬�������������ʱ��仯��������ͼ������˵����ȷ���� ������ţ� ��
��A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2��P1
��B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P1��P2
��C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2
��D��ͼ�������ͬ��ͬѹ�£��������ܶԷ�Ӧ��Ӱ�죬��1��2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com