




科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验内容 | 实验目的或实验结论 |
| A | 向盛有2 mL 0.1 mol/L AgNO3溶液的试管中滴加5滴0.1 mol/L NaCl溶液,有白色沉淀生成,再向其中滴加5滴0.1 mol/L KI溶液 | 说明一种沉淀能转化为溶解度更小的沉淀 |
| B | 向1 mL 20% 的蔗糖溶液中加入3~5滴稀硫酸,水浴加热5 min,冷却后再加入新制Cu(OH)2悬浊液,加热 | 证明蔗糖能发生水解反应 |
| C | 水浴加热浓硝酸、浓硫酸和苯的混合物后,直接蒸馏分液后得到的粗产品 | 制备纯硝基苯 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
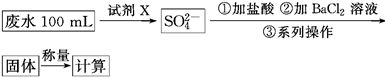
查看答案和解析>>
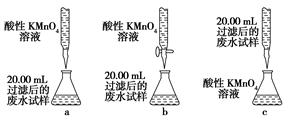
科目:高中化学 来源:不详 题型:单选题
| A.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| B.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| C.在硫酸镁溶液中加入氢氧化钠可以得到氢氧化镁沉淀 |
| D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
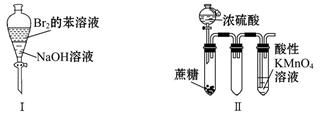
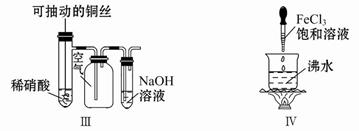
| A.振荡后静置,上层溶液颜色保持不变 |
| B.实验Ⅱ:酸性KMnO4溶液中出现气泡,颜色无变化 |
| C.实验Ⅲ:微热稀硝酸片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
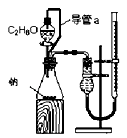 | 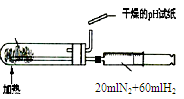 | 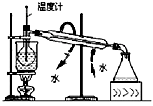 | 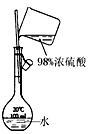 |
| A.测定乙醇分子结构 | B.合成氨并检验氨的生成并回收CCl4 | C.碘的CCl4溶液中分离I2 | D.配制稀硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 实验方案 |
| A | 研究催化剂对过氧化氢分解速率的影响 | 分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一只试管中加入少量MnO2 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mol/LNaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 可以鉴别这两种溶液 | 将Na2CO3溶液与HCl溶液相互滴加 |
| D | 测定铝箔中氧化铝的含量 | 取a g铝箔与足量稀盐酸充分反应,将逸出的气体通过碱石灰后,测其体积为bL(标准状况下) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com