
实验室利用如图装置进行中和热的测定。回答下列问题: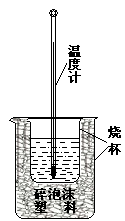
(1)该图中有两处实验用品未画出,它们是 、 ;
(2)在操作正确的前提下提高中和热测定的准确性的关键是: 。
(3)如果用0.5mol?L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将 (填“偏大”、“偏小”、“不变”)原因是 。
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:填空题
(9分)(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_________________________________________________。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
 Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
⑴人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2或HCHO”)。
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g)
△H= 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式: 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
⑵一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为
g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为?890.3kJ?mol?1、?285. 8 kJ?mol?1和?283.0 kJ?mol?1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):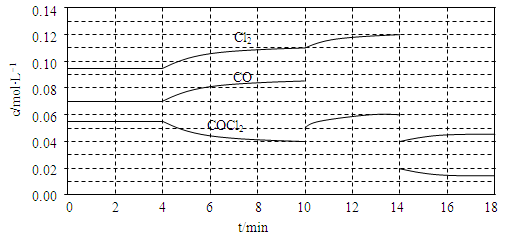
①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5?6min和15?16 min时平均反应速率的大小:v(5?6)
v(15?16)(填“<”、“>”或“=”),原因是 。
③计算反应在第8 min时的平衡常数K= ;(列出计算过程,结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l) ΔH=-726.5 kJ·mol-1、CO(g) +1/2O2(g)= CO2 (g) ΔH=-283.0 kJ·mol-1。
请回答下列问题:
⑴用太阳能分解18g水,需要消耗的能量为 kJ。
⑵ 液态CH3OH不完全燃烧生成CO和液态H2O的热化学方程式为 。
⑶CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):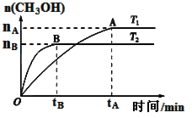
①下列说法正确的是
A.温度为T2时,从反应开始到平衡,生成甲醇的平均速率为: v(CH3OH)=nB/tB mol·(L·min)-1
B.T2>T1,T2平衡时,甲醇产量变少,所以该反应为放热反应
C.该反应在T2时的平衡常数比T1时的平衡常数大
D.处于A点的反应体系从T1变到T2,平衡逆向移动
②能判断该反应已达化学反应限度标志的是 (填字母。
A.H2的百分含量保持不变
B.容器中CO2 浓度与H2浓度之比为1: 3
C.容器中混合气体的密度保持不变
D.CO2消耗速率与CH3OH生成速率相等
⑷科学家致力于CO2的“组合转化”技术研究,如将CO2和H2以体积比1∶4比例混合通入反应器,适当条件下,反应可获得一种能源。完成以下化学方程式,就能知道该种能源。
CO2+4H2 2H2O + 。
2H2O + 。
⑸ 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为:2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ;负极的反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
平衡是化学反应原理中的重要内容。按要求回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常数为K2
2NO2(g) ΔH2 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。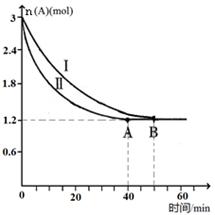
①实验Ⅱ可能改变的条件是_______________。
②T1℃时该反应的平衡常数为_____(用分数表 示),达到平衡时,A的反应速率为____。
(3)已知HCN溶液的电离平衡常数Ka=10-5mol?L-1,c平衡(HCN)≈c起始(HCN),水的电离可不计,则此温度下0.1 mol?L-1的HCN溶液的pH=_________。
(4)对于0.1mol?L-1 Na2CO3溶液,该溶液中离子浓度由大到小的顺序是______,向该溶液中加水稀释的过程中,c(H2CO3)逐渐____(填“增大”“不变”或“减小”, 下同) ,c(H2CO3)/ c(CO32-)逐渐______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
则反应CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。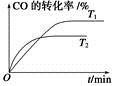
①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。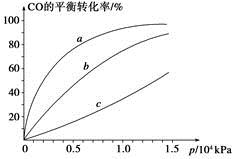
③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g) CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。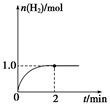
0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g) CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
A.平衡常数 B.CH3OH的平衡浓度
C.达到平衡的时间 D.平衡时气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应放出11.46 kJ的热量,该反应的热化学方程式为 ,则KOH与H2SO4的中和热为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com