
分析 Ⅰ.(1)平衡常数为气体生成物与气体反应物的浓度幂之积的比值;
(2)列三段式求出0~0.5min内反应消耗的CO,再求出其反应速率;
(3)达到平衡时,正逆反应速率相等,各物质的浓度、含量不变;
(4)该反应反应前后气体的物质的量相同,保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则达到平衡时与原平衡是等效平衡,根据等效平衡的特点分析;
II.2HI(g)?H2(g)+I2(g)反应前后体积不变,改变压强,平衡不移动;
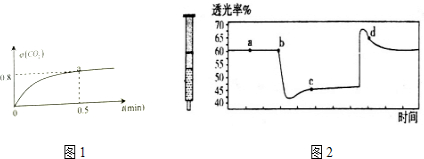
III.该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大.
解答 解:I.(1)平衡常数为气体生成物与气体反应物的浓度幂之积的比值,由于反应物、生成物各一种气体,平衡常数为K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$,
故答案为:$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$;
(2)设0~0.5min内反应消耗的CO为xmol,
5CO(g)+I2O5(g)?5CO2(g)+I2(s)
起始量(mol):1 0
反应量(mol):x x
平衡量(mol):1-x x
则 $\frac{xmol}{1mol}$=0.8,所以x=0.8,则v(CO)=$\frac{\frac{n}{V}}{t}$=$\frac{\frac{0.8mol}{2L}}{5min}$=0.8mol/(mol•L),
故答案为:0.8mol/(mol•L);
(3)A.反应前后气体的体积不变,则容器内压强不再变化不能说明达到平衡状态,故A错误;
B.CO的质量不再变化,CO2的转化率不再增大,可说明达到平衡状态,故B正确;
C.反应没有停止,不存在反应物不再转化为生成物的说法,故C错误;
D.混合气体的平均相对分子质量不再改变,可说明气体的质量不变,可说明达到平衡状态,故D正确.
故答案为:BD;
(4)保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,
A.等效平衡的转化率相同,若开始加入CO(g)的物质的量是原来的2倍,则生成I2的质量为原来的2倍,故A正确;
B.浓度增大,反应速率增大,达到平衡的时间减少,故B错误;
C.达到相同的平衡状态,则平衡时混合气体的物质的量为原来的2 倍,故C正确;
D.加入气体增多,气体密度增大,故D错误.
故答案为:AC;
II.反应2HI(g)?H2(g)+I2(g)前后气体物质的量不变,所以增大容器体积,平衡不移动,故答案为:不移动;
III.A.b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A正确;
B.c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C.b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),升温平衡逆向移动,平衡常数减小,所以Kb>Kc,故C正确;
D.c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;
故答案为:AC.
点评 本题考查了化学平衡的有关计算、影响平衡的因素,为高考常见题型,题目综合性较强,难度较大,侧重于考查学生对知识的综合应用能力和数据处理能力.


科目:高中化学 来源: 题型:选择题
| A. | Na、K--遇湿易燃物品 | B. | TNT、NH4NO3--爆炸品 | ||
| C. | CH4、C2H5OH--易燃气体 | D. | 浓H2SO4、浓HNO3--腐蚀品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)重复出现 | |
| D. | 随着元素原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强重复出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该混合物一定是K2CO3和NaCl | B. | 该混合物可能是Na2CO3和KCl | ||
| C. | 该混合物可能是Na2SO4和Na2CO3 | D. | 该混合物一定是Na2CO3和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸光照逐渐变黄,说明光照分解生成的有色产物能溶于其中 | |
| B. | 中和滴定时,眼睛应注视滴定管中的液面下降 | |
| C. | 向饱和FeCl3溶液中滴加过量氨水,可制得Fe(OH)3胶体 | |
| D. | 配制一定物质的量浓度的溶液时,应将刚溶解后的溶液立即转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式为CH3CH2OH,分子式为C2H5OH | |
| B. | 乙酸的电离方程式为CH3COOH=CH3COO-+H+ | |
| C. | 中子数为16的磷原子可表示为${\;}_{15}^{31}$P | |
| D. | S2-结构示意图为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀是BaSO4和BaSO3 | B. | FeCl3全部被还原为FeCl2 | ||
| C. | 白色沉淀是BaSO3 | D. | 溶液的酸性减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com