
| A. | HPO32-既能电离也能水解 | |
| B. | Na2HPO3溶液一定呈碱性 | |
| C. | H3PO3具有还原性 | |
| D. | H3PO3的溶液中加入过量NaOH,生成Na3PO3 |
分析 亚磷酸(H3PO3)是二元酸,0.1000mol/L的H3PO3溶液pH=1.6,说明亚磷酸是二元弱酸;
A.亚磷酸是二元弱酸,HPO32-为亚磷酸酸根离子;
B.Na2HPO3为强碱弱酸盐,亚磷酸根离子能发生水解反应;
C.亚磷酸中P元素化合价为+3价,处于中间价态;
D.Na2HPO3为亚磷酸正盐.
解答 解:亚磷酸(H3PO3)是二元酸,0.1000mol/L的H3PO3溶液pH=1.6,说明亚磷酸是二元弱酸;
A.亚磷酸是二元弱酸,HPO32-为亚磷酸酸根离子,能发生水解但不能电离,故A错误;
B.Na2HPO3为强碱弱酸盐,亚磷酸根离子能发生水解反应而使其水溶液呈碱性,故B正确;
C.亚磷酸中P元素化合价为+3价,处于中间价态,具有氧化性和还原性,故C正确;
D.亚磷酸是二元酸,则Na2HPO3为亚磷酸正盐,所以H3PO3的溶液中加入过量NaOH,生成Na2HPO3,故D错误;
故选AD.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生获取信息利用信息解答问题能力,正确理解“二元酸”概念是解本题关键,注意亚磷酸正盐中含有H元素,易错选项是D.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA | |
| B. | 1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | H2S的水溶液中存在下列平衡:H2S?2H++S2- | |
| D. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8或C5H8 | B. | C3H8或C5H8 | C. | C4H8或C3H8 | D. | C5H8或C6H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g乙酸与甲酸甲酯的混合物中含有氧原子数目为0.2NA | |
| B. | 苯与液溴反应生成1mol溴苯分子,消耗0.5NA个Br2 | |
| C. | 常温常压下,等质量的N2H4和CH3OH含有相同数目的原子 | |
| D. | 6gSiO2晶体中含有0.4NA个Si-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫的接触氧化在合成塔中发生 | |
| B. | 吸收塔得到的硫酸浓度为98% | |
| C. | 煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% | |
| D. | 接触室中适宜条件是V2O5作催化剂、高温、常压 | |
| E. | 接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
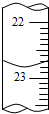 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
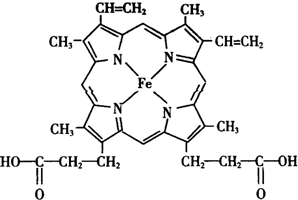 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: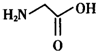 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.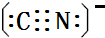 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
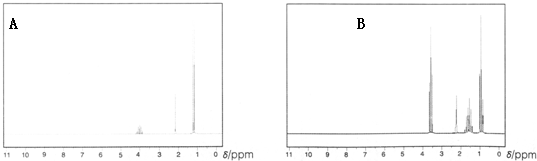
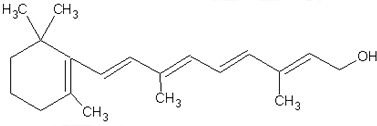
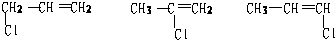 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com