
分析 V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于18,其中X是金属元素,V元素原子的最外层都只有一个电子,则V元素位于第IA族,只有X是金属元素,则V为H元素;
W和Y元素原子的最外层电子数相同,二者位于同一主族,且W元素原子L层电子数是K层电子数的3倍,则W的L层电子数是6,为O元素,则Y是S元素,Z原子序数大于Y且小于18,为Cl元素;
X元素原子的最外层电子数是Y元素原子最外层电子数的一半,且X为金属元素,则X为Al,据此分析解答.
解答 解:V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于18,其中X是金属元素,V元素原子的最外层都只有一个电子,则V元素位于第IA族,只有X是金属元素,则V为H元素;
W和Y元素原子的最外层电子数相同,二者位于同一主族,且W元素原子L层电子数是K层电子数的3倍,则W的L层电子数是6,为O元素,则Y是S元素,Z原子序数大于Y且小于18,为Cl元素;
X元素原子的最外层电子数是Y元素原子最外层电子数的一半,且X为金属元素,则X为Al;
通过以上分析知,V、W、X、Y、Z五种元素分别是H、O、Al、S、Cl元素,故答案为:H;O;Al;S.
点评 本题考查位置结构性质相互关系及应用,为高频考点,侧重考查学生对原子结构、元素周期表结构的认识,明确原子构成、元素周期表结构即可解答,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1000mL水中所含K+、SO42-总数为0.15NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+的浓度为0.1mol/L | |
| D. | 1L溶液中SO42-的浓度是0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| D. | 按系统命名法,化合物 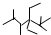 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 35.5表示氯元素的近似相对原子质量 | |
| C. | 24.23%表示35Cl的丰度 | |
| D. | 36.966表示37Cl的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | XOH物质的量浓度(mol•L-1) | 盐酸物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

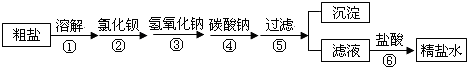
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com