
| A. | 80% | B. | 65% | C. | 45% | D. | 37% |
分析 若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,说明增大压强不影响平衡移动,则x+1=1+1,故x=1,又由于c(X)c(Y)=c(Z)c(R),则平衡常数K=1,设平衡时转化的X为amol,表示出平衡时各组分物质的量,反应前后气体的物质的量相等,利用物质的量代替浓度放入平衡常数列方程计算解答.
解答 解:在t℃时,将0.2mol X和0.8mol Y充入密闭容器中,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,说明增大压强不影响平衡移动,则x+1=1+1,故x=1,又由于c(X)c(Y)=c(Z)c(R),则平衡常数K=1,
设平衡时转化的X为amol,则:
X(g)+Y(g)?Z(g)+R(g)
起始量(mol):0.2 0.8 0 0
转化量(mol):a a a a
平衡量(mol):0.2-a 0.8-a a a
所以$\frac{a×a}{(0.2-a)×(0.8-a)}$=1,解得a=0.16
故X的转化率为$\frac{0.16mol}{0.2mol}$×100%=80%,
故选:A.
点评 本题考查化学平衡计算,关键是确定Z的化学计量数,注意平衡常数的理解及有关应用.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl,SO2,S2,300℃以上万全分解: S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2SCl2 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
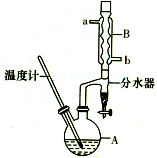 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:| 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温下压缩体积,容器中气体的平均相对分子质量减少 | |
| B. | 再加入一定量氨基甲酸铵,平衡正向移动 | |
| C. | CO2的体积分数不变则该反应达到平衡状态 | |
| D. | 25℃时氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1氨水中加入适量NH4Cl(s),则混合液中c(NH4+)与c(NH3•H2O)之比增大 | |
| B. | 25℃时,0.1mol•L-1氨水和0.05 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 0.1mol•L-1 CH3COOH溶液中,c(CH3COO-)=c(H+) | |
| D. | 向0.1mol•L-1KNO3溶液中,滴加稀盐酸至溶液pH=5,此时混合液中c(K+)<c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com