
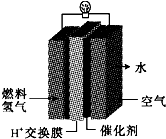
 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车, 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

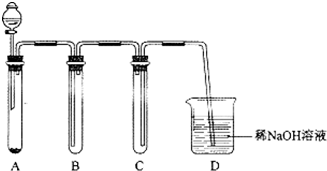
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
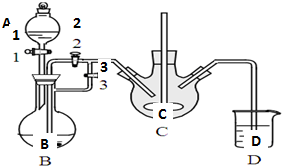 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O | |
| B. | 硅酸钠水溶液中通入足量的二氧化碳:SiO32-+CO2+2H2O=H2SiO3(胶体)+CO32- | |
| C. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| D. | 铝片加入烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X) | |
| B. | 元素Z、W的简单离子的电子层结构相同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | X、Y两种元素可形成分别含有10e-和18e-的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
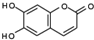 已知
已知 和NaOH 反应能生成RCOONa和R′OH,下列叙述正确的是( )
和NaOH 反应能生成RCOONa和R′OH,下列叙述正确的是( )| A. | M的相对分子质量是180 | |
| B. | 1mol M最多能与2molBr2发生反应 | |
| C. | 1molM与足量的NaOH溶液发生反应,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1molM与足量NaHCO3反应能生成2molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2 | B. | CO2和O2 | C. | NO2和O2 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com