




科目:高中化学 来源: 题型:
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
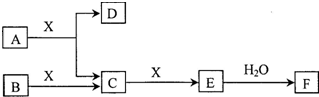 由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):
由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、充电电池可以无限制地反复放电、充电 |
| B、充电是使放电时的氧化还原反应逆向进行 |
| C、较长时间不使用电器时,最好从电器中取出电池,并妥善存放 |
| D、充电电池的化学反应原理是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com