
分析 (1)①根据中和滴定的一般步骤:检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作排序;
②氢氧化钠与硫酸恰好中和溶液的pH为7,可选择酸性或碱性变色范围内的指示剂;
③根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小;
解答 解:(1)①中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,所以滴定操作的正确顺序是:ECDBAGF;
故答案为:ECDBAGF;
②氢氧化钠与硫酸恰好中和溶液的pH为7,可选择酸性变色范围内的指示剂甲基橙,也可选择碱性变色范围内的指示剂酚酞;
故答案为:甲基橙或酚酞;
③用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色,则到达滴定终点;用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色,则到达滴定终点;
故答案为:用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色或用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,滴定管内壁上的水膜,将标准液稀释,使体积读数偏大,所以计算结果偏大;
故答案为:偏大;滴定管内壁上的水膜,将标准液稀释,使体积读数偏大.
点评 本题考查了酸碱中和滴定,题目难度中等,涉及了实验步骤、滴定方法、误差分析、浓度计算等知识,注意掌握误差分析的方法.


科目:高中化学 来源: 题型:选择题
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=+57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$ O2 (g)=8CO2 (g)+9H2O(g)△H=-5518kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)△H=-11036kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
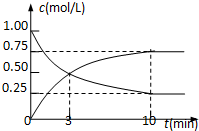 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
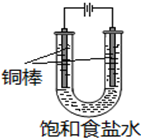 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
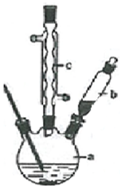 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: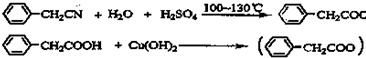
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
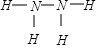 ,已知液态肼的标准燃烧热为-622kJ/mol,写出发生燃烧发生的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.
,已知液态肼的标准燃烧热为-622kJ/mol,写出发生燃烧发生的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l);△H=-622KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
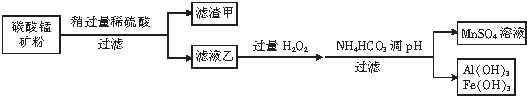
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5min内用O2表示的反应速率为0.12mol/(L•min) | |
| B. | 加入催化剂,可使该反应的化学反应速率加快,△H变小 | |
| C. | SO2的平衡浓度为0.12mol/L | |
| D. | 达到平衡时,若增大容器的体积,则该反应的化学反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉在溶液中存在平衡:ClO-+H2O?HClO+OH-,加少量NaOH能提高其漂白效率 | |
| B. | 硫酸钡难溶子水,但硫酸钡属于强电解质 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏大 | |
| D. | 物质的量浓度相同的四种溶液:①氯化铵②硫酸氢铵 ③次氯酸铵④碳酸铵的pH:④>②>①>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com