
分析 有A、B、C、D、E、F六种短周期的主族元素,原子序数依次增大,B元素位于元素周期表中的第二周期,且原子最外层电子数占核外电子总数的$\frac{3}{4}$,设其最外层电子数为x,则(2+x)×$\frac{3}{4}$=x,解得x=6,故B为O元素;A、D元素的原子最外层均只有一个电子,处于IA族,且A和B处于不同周期,结合原子序数可知A为H元素、D为Na;C、F同主族,C的原子序数介于氧、Na之间,则C为F元素、F为Cl;F元素原子最外电子层比同周期E元素原子的最外电子层多5个电子,则E原子最外层电子数为2,故E为Mg,据此解答.
解答 解:有A、B、C、D、E、F六种短周期的主族元素,原子序数依次增大,B元素位于元素周期表中的第二周期,且原子最外层电子数占核外电子总数的$\frac{3}{4}$,设其最外层电子数为x,则(2+x)×$\frac{3}{4}$=x,解得x=6,故B为O元素;A、D元素的原子最外层均只有一个电子,处于IA族,且A和B处于不同周期,结合原子序数可知A为H元素、D为Na;C、F同主族,C的原子序数介于氧、Na之间,则C为F元素、F为Cl;F元素原子最外电子层比同周期E元素原子的最外电子层多5个电子,则E原子最外层电子数为2,故E为Mg.
(1)H、O、Mg三种元素组成的化合物为Mg(OH)2,故答案为:Mg(OH)2;
(2)D的最高价氧化物的水化物为NaOH,C的氢化物为HF,在水溶液中反应的离子方程式为:OH-+HF=F-+H2O,
故答案为:OH-+HF=F-+H2O;
(3)D元素最高价氧化物的水化物为NaOH,F的最高价氧化物的水化物为HClO4,1molNaOH与HClO4放出akJ的热量,则热化学方程式为:NaOH(aq)+HClO4(aq)=NaClO4(aq)+H2O(l)△H=-a kJ/mol,
故答案为:NaOH(aq)+HClO4(aq)=NaClO4(aq)+H2O(l)△H=-a kJ/mol.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,注意掌握热化学方程式的书写.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
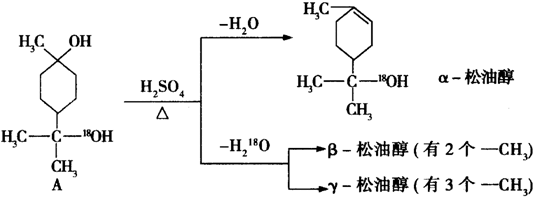
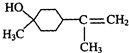 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$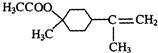 +H2O.
+H2O.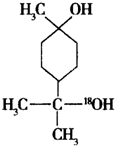 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$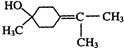 +H218O,该反应的反应类型是消去反应.
+H218O,该反应的反应类型是消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
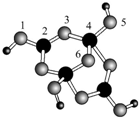 硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型有sp2和sp3;配位键存在于4,5或(5,4)原子之间(填原子的数字标号);m=2(填数字).
硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型有sp2和sp3;配位键存在于4,5或(5,4)原子之间(填原子的数字标号);m=2(填数字).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
| A. | 在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是4 一5 min,因为在此段时间内反应放出的热量较多 | |
| B. | 在2一3min时间段内,用盐酸的浓度变化表示的反应速率为0.lmol/(L•min) | |
| C. | 在该稀盐酸中分别加入等体积的蒸馏水、Na2SO4溶液或Na2CO3溶液都能减缓反应速率且不减少产生氢气的量 | |
| D. | 为了加快该化学反应速率,可以向其中加入NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,A2C2的结构式:H-O-O-H.
,A2C2的结构式:H-O-O-H. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用蒸馏法提纯工业乙醇 | |
| B. | 葡萄糖用于制镜业是利用了葡萄糖的还原性 | |
| C. | 1mol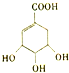 最多可与4 mol NaOH 发生反应 最多可与4 mol NaOH 发生反应 | |
| D. | 1-氯丙烷和2-氯丙烷分别与NaOH 乙醇溶液共热,都可得到丙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com