
ŅŃÖŖ£ŗI2£«2S2O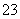 ===S4O
===S4O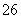 £«2I£
£«2I£
Ļą¹ŲĪļÖŹµÄČܶȻż³£Źż¼ūĻĀ±ķ£ŗ
| ĪļÖŹ | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2”Į10£20 | 2.6”Į10£39 | 1.7”Į10£7 | 1.3”Į10£12 |
(1)ijĖįŠŌCuCl2ČÜŅŗÖŠŗ¬ÓŠÉŁĮæµÄFeCl3£¬ĪŖµĆµ½“æ¾»µÄCuCl2”¤2H2O¾§Ģ壬¼ÓČė____ ____£¬µ÷ÖĮpH£½4£¬Ź¹ČÜŅŗÖŠµÄFe3£«×Ŗ»ÆĪŖFe(OH)3³Įµķ£¬“ĖŹ±ČÜŅŗÖŠµÄc(Fe3£«)£½__ ______”£¹żĀĖŗ󣬽«ĖłµĆĀĖŅŗµĶĪĀÕō·¢”¢ÅØĖõ½į¾§£¬æɵĆCuCl2”¤2H2O¾§Ģ唣
(2)ŌŚæÕĘųÖŠÖ±½Ó¼ÓČČCuCl2”¤2H2O¾§ĢåµĆ²»µ½“æµÄĪŽĖ®CuCl2£¬ŌŅņŹĒ(ÓĆ»Æѧ·½³ĢŹ½±ķŹ¾)_________________ ____________”£ÓÉCuCl2”¤2H2O¾§ĢåµĆµ½“æµÄĪŽĖ®CuCl2µÄŗĻĄķ·½·ØŹĒ_________ ___________________”£
(3)Ä³Ń§Ļ°Š”×éÓĆ”°¼ä½ÓµāĮæ·Ø”±²ā¶Øŗ¬ÓŠCuCl2”¤2H2O¾§ĢåµÄŹŌŃł(²»ŗ¬ÄÜÓėI£·¢Éś·“Ó¦µÄŃõ»ÆŠŌŌÓÖŹ)µÄ“æ¶Č£¬¹ż³ĢČēĻĀ£ŗČ”0.36 gŹŌŃłČÜÓŚĖ®£¬¼ÓČė¹żĮæKI¹ĢĢ壬³ä·Ö·“Ó¦£¬Éś³É°×É«³Įµķ”£ÓĆ0.100 0 mol”¤L£1 Na2S2O3±ź×¼ČÜŅŗµĪ¶Ø£¬µ½“ļµĪ¶ØÖÕµćŹ±£¬ĻūŗÄNa2S2O3±ź×¼ČÜŅŗ20.00 mL”£
¢ŁæÉŃ”ÓĆ______ __×÷µĪ¶ØÖøŹ¾¼Į£¬µĪ¶ØÖÕµćµÄĻÖĻóŹĒ__________________ ____”£
¢ŚCuCl2ČÜŅŗÓėKI·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________ ________________”£
¢ŪøĆŹŌŃłÖŠCuCl2”¤2H2OµÄÖŹĮæ°Ł·ÖŹżĪŖ____ ____”£
 ³¤½×÷Ņµ±¾Ķ¬²½Į·Ļ°²įĻµĮŠ“š°ø
³¤½×÷Ņµ±¾Ķ¬²½Į·Ļ°²įĻµĮŠ“š°ø Š”Ģģ²ÅæĪŹ±×÷ŅµĻµĮŠ“š°ø
Š”Ģģ²ÅæĪŹ±×÷ŅµĻµĮŠ“š°ø Ņ»æĪĖÄĮ·ĻµĮŠ“š°ø
Ņ»æĪĖÄĮ·ĻµĮŠ“š°ø »ĘøŌŠ”דŌŖĀś·Ö³å“ĢĪ¢²āŃéĻµĮŠ“š°ø
»ĘøŌŠ”דŌŖĀś·Ö³å“ĢĪ¢²āŃéĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½šŹōīŃ(Ti)ŠŌÄÜÓÅŌ½£¬±»³ĘĪŖ¼ĢĢś”¢ĀĮÖ®ŗóµÄ”°µŚČż½šŹō”±”£¹¤ŅµÉĻŅŌ½šŗģŹÆĪŖŌĮĻÖĘČ”
TiµÄ·“Ó¦ĪŖ
 aTiO2 + bCl2+eC aTiCl4+eCO ¢ń
aTiO2 + bCl2+eC aTiCl4+eCO ¢ń
TiCl4£«2Mg Ti£«2MgCl2”” ¢ņ
¹ŲÓŚ·“Ó¦¢ń”¢¢ņµÄ·ÖĪö²»ÕżČ·µÄŹĒ
¢ŁTiCl4ŌŚ·“Ó¦¢ńÖŠŹĒ»¹Ō²śĪļ£¬ŌŚ·“Ó¦¢ņÖŠŹĒŃõ»Æ¼Į£»¢ŚC”¢MgŌŚĮ½øö·“Ó¦ÖŠ¾ł±»»¹Ō£»
¢ŪŌŚ·“Ó¦¢ń”¢¢ņÖŠMgµÄ»¹ŌŠŌ“óÓŚC£¬CµÄ»¹ŌŠŌ“óÓŚTiCl4£»
¢Üa=1£¬b=e =2 ¢ŻĆæÉś³É19.2 g Ti£¬·“Ó¦¢ń”¢¢ņÖŠ¹²×ŖŅĘ4.8 mol e£”£
A£®¢Ł¢Ś¢Ü B£®¢Ś¢Ū¢Ü C£®¢Ū¢Ü D£®¢Ś¢Ū¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀ±ķÖŠĪļÖŹµÄ·ÖĄą×éŗĻĶźČ«ÕżČ·µÄŹĒ(””””)
| ±ąŗÅ | A | B | C | D |
| Ēæµē½āÖŹ | Ba(OH)2 | ŃĪĖį | HClO4 | BaSO4 |
| Čõµē½āÖŹ | HI | CaCO3 | HClO | NH3”¤H2O |
| ·Ēµē½āÖŹ | SO2 | NH3 | Cl2 | ŅŅ“¼ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
A£®³£ĪĀĻĀ£¬½«pH£½3µÄ“×ĖįČÜŅŗĻ”ŹĶµ½ŌĢå»żµÄ10±¶ŗó£¬ČÜŅŗµÄpH£½4
B£®ĪŖČ·¶ØijĖįH2AŹĒĒæĖį»¹ŹĒČõĖį£¬æɲāNaHAČÜŅŗµÄpH”£ČōpH>7£¬ŌņH2AŹĒČõĖį£»ČōpH<7£¬ŌņH2AŹĒĒæĖį
C£®ÓĆ0.200 0 mol”¤L£1 NaOH±ź×¼ČÜŅŗµĪ¶ØHClÓėCH3COOHµÄ»ģŗĻŅŗ(»ģŗĻŅŗÖŠĮ½ÖÖĖįµÄÅØ¶Č¾łŌ¼ĪŖ0.1 mol”¤L£1)£¬ÖĮÖŠŠŌŹ±£¬ČÜŅŗÖŠµÄĖįĪ“±»ĶźČ«ÖŠŗĶ
D£®ĻąĶ¬ĪĀ¶ČĻĀ£¬½«×ćĮæĀČ»ÆŅų¹ĢĢå·Ö±š·ÅČėĻąĶ¬Ģå»żµÄ¢ŁÕōĮóĖ®”¢¢Ś0.1 mol”¤L£1ŃĪĖį”¢¢Ū0.1 mol”¤L£1ĀČ»ÆĆ¾ČÜŅŗ”¢¢Ü0.1 mol”¤L£1ĻõĖįŅųČÜŅŗÖŠ£¬Ag£«ÅØ¶Č£ŗ¢Ł>¢Ü£½¢Ś>¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijĪĀ¶ČŹ±£¬²āµĆ0.01 mol”¤L£1µÄNaOHČÜŅŗµÄpHĪŖ11£¬ŌņøĆĪĀ¶ČĻĀĖ®µÄĄė×Ó»ż³£ŹżĪŖ________________”£
ŌŚ“ĖĪĀ¶ČĻĀ½«pH£½aµÄH2SO4ČÜŅŗVaLÓėpH£½bµÄNaOHČÜŅŗVbL»ģŗĻ”£
(1)ČōĖłµĆ»ģŗĻŅŗĪŖÖŠŠŌ£¬ĒŅa£½2£¬b£½12£¬ŌņVa£ŗVb£½____ ____”£
(2)ČōĖłµĆ»ģŗĻŅŗµÄpH£½10£¬ĒŅa£½2£¬b£½12£¬ŌņVa£ŗVb£½______ __”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ņ»¶ØĪĀ¶ČĻĀ£¬ÄŃČÜĒæµē½āÖŹµÄ±„ŗĶČÜŅŗÖŠ“ęŌŚ×ųĮµķČܽāĘ½ŗā£¬ĘäĘ½ŗā³£ŹżĪŖ
| ĪļÖŹ | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp£Ø25”ę£© | 8.0”Į10©16 | 2.2”Į10©20 | 4.0”Į10©38 |
¶ŌÓŚŗ¬Fe2(SO4)3”¢FeSO4ŗĶCuSO4ø÷0.5molµÄ»ģŗĻČÜŅŗ1L£¬øł¾ŻÉĻ±ķŹż¾ŻÅŠ¶Ļ£¬Ėµ
·Ø“ķĪóµÄŹĒ
”” A£® Ļņ»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓČėNaOHČÜŅŗ£¬×īĻČ擵½ŗģŗÖÉ«³Įµķ
”” B£® ĻņČÜŅŗÖŠ¼ÓČėĖ«ŃõĖ®£¬²¢ÓĆCuO·ŪÄ©µ÷½ŚpH£¬¹żĀĖŗóæÉ»ń½Ļ“æ¾»µÄCuSO4ČÜŅŗ
”” C£® øĆČÜŅŗÖŠc£ØSO42©£©£ŗ[c£ØFe3+£©+c£ØFe2+£©+c£ØCu2+£©]=5£ŗ4
”” D£® ½«ÉŁĮæFeCl3·ŪÄ©¼ÓČėŗ¬Cu£ØOH£©2µÄŠü×ĒŅŗÖŠ£¬ĘäÖŠc£ØCu2+£©Ōö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖA”¢B”¢C”¢D”¢EĪåÖÖŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ĘäÖŠAŌ×ÓĖł“¦µÄÖÜĘŚŹż”¢×åŠņŹż¶¼ÓėĘäŌ×ÓŠņŹżĻąµČ£»BŌ×ÓŗĖĶāµē×ÓÓŠ6ÖÖ²»Ķ¬µÄŌĖ¶ÆדĢ¬£¬s¹ģµĄµē×ÓŹżŹĒp¹ģµĄµē×ÓŹżµÄĮ½±¶£»DŌ×ÓLµē×Ó²ćÉĻÓŠ2¶Ō³É¶Ōµē×Ó£»E£«Ō×ÓŗĖĶāÓŠ3²ćµē×ÓĒŅø÷²ć¾ł“¦ÓŚČ«Āś×“Ģ¬”£
ĒėĢīŠ“ĻĀĮŠæÕ°×”£
£Ø1£©EŌŖĖŲ»łĢ¬Ō×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ_________________”£
£Ø2£©B”¢C”¢DČżÖÖŌŖĖŲµÄµŚŅ»µēĄėÄÜŹżÖµÓÉŠ”µ½“óµÄĖ³ŠņĪŖ_____________£ØĢīŌŖĖŲ·ūŗÅ£©£¬ĘäŌŅņĪŖ_____________________”£
£Ø3£©B2A4ŹĒÖŲŅŖµÄ»ł±¾ŹÆÓĶ»Æ¹¤ŌĮĻ”£B2A4·Ö×ÓÖŠBŌ×Ó¹ģµĄµÄŌÓ»ÆĄąŠĶĪŖ__________£»
1 mol B2A4·Ö×ÓÖŠŗ¬__________mol¦Ņ¼ü”£
£Ø4£©ŅŃÖŖD”¢EÄÜŠĪ³É¾§°ūČēĶ¼ĖłŹ¾µÄĮ½ÖÖ»ÆŗĻĪļ£¬»ÆŗĻĪļµÄ»ÆѧŹ½£¬¼×ĪŖ__________£¬ŅŅĪŖ_____________£»øßĪĀŹ±£¬¼×Ņ××Ŗ»ÆĪŖŅŅµÄŌŅņĪŖ__________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷×éČČ»Æѧ·½³ĢŹ½ÖŠ£¬”÷H1 > ”÷H2 µÄŹĒ( )
¢ŁC(s)£«O2(g)===CO2(g) ”÷H1 C(s)£«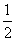 O2(g)===CO(g) ”÷H2
O2(g)===CO(g) ”÷H2
¢ŚS(s)£«O2(g)===SO2(g) ”÷H1 S(g)£«O2(g)===SO2(g) ”÷H2
¢ŪH2(g)£«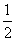 O2(g)===H2O(l) ”÷H1 2H2(g)£«O2(g)===2H2O(l) ”÷H2
O2(g)===H2O(l) ”÷H1 2H2(g)£«O2(g)===2H2O(l) ”÷H2
¢ÜCaCO3(s)===CaO(s)£«CO2(g) ”÷H1 CaO(s)£«H2O(l)===Ca(OH)2(s) ”÷H2
A£®¢Ł B£®¢Ü C£®¢Ś¢Ū¢Ü D£®¢Ł¢Ś¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷×éĄė×ÓŌŚÖø¶ØµÄ»·¾³ÖŠÄÜ“óĮæ“ęŌŚµÄŹĒ
A£®pH=1µÄĪŽÉ«ČÜŅŗÖŠ£ŗSO42”Ŗ”¢Cu2+”¢Na+”¢Cl”Ŗ
B£®ÄÜŹ¹ŹÆČļŹŌÖ½±äĄ¶É«µÄČÜŅŗÖŠ£ŗNa+”¢K+”¢S2”Ŗ”¢CO32”Ŗ
C£®¼ÓČėĀĮ·ŪÄܲśÉśH2µÄČÜŅŗÖŠ£ŗNH4+”¢Na+”¢Fe2+”¢NO3”Ŗ
D£®Ė®µēĄė³öµÄc(H+)=1”Į10-12mol/LµÄČÜŅŗÖŠ£ŗK+”¢Na+”¢Cl-”¢HCO3”Ŗ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com