
下列比较中正确的是( )
A.离子还原性:S2- > Cl- > Br - > I- B. 氧化性:F2 > Cl2 > Br2 >S
C.酸性:H2SO4 > HClO4 > H3PO4 D.非金属性:F > Cl > S > O
科目:高中化学 来源: 题型:
把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ( )
A.0.1(b-2a) mol·L-1 B.10(2a-b) mol·L-1
C.10(b-a) mol·L-1 D.10(b-2a) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
A.四种元素的原子半径:rZ>rX>rY>rW
B.X、Y、Z、W形成的单质最多有6种
C.四种元素均可与氢元素形成18电子分子
D.四种元素中,Z的最高价氧化物对应水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为__________________;元素Z的离子结构示意图为________________。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为________________。
(3)元素W位于周期表的第________族,其非金属性比R弱,用原子结构的知识解释原因:________________。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:____________________________。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于原子结构的叙述正确的是 ( )
A.所有的原子核都是由质子和中子组成的
B.原子的次外层电子数都是8
C.稀有气体原子的最外层电子数均为8
D.原子的最外层电子数不超过8个
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是 ( )
A.X和Y的总能量一定低于M和N的总能量
B.X的能量一定低于M的,Y的能量一定低于N的
C.因为该反应为吸热反应,故一定要加热反应才能进行
D.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
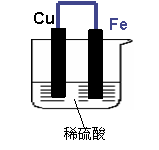
如下图所示,将铁、铜通过导线相连,置于稀硫酸中。
铁片为 极,电极上发生的是 反应(填“氧化”或“还原”),
电极反应式为 ,铁片上观察到的现象为 。
铜片为 极,电极上发生的是 反应,电极反应式是 ,铜片上观察到的现象是 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
块状大理石与过量的3 mol·L—1盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是:①加入一定量的氯化钠固体 ②改用6 mol·L—1盐酸 ③改用粉末状大理石 ④适当升高温度
A.①②④ B.②③④ C.①③④ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com