
【题目】某校化学兴趣小组实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图:
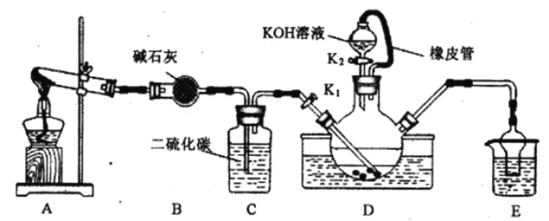
实验步骤如下:
(1)制备 NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S。该反应比较缓慢。
NH4SCN+H2S。该反应比较缓慢。
①实验前,应进行的操作是______________________。三颈烧瓶内盛放有CS2、水和催化剂,三颈烧瓶的下层CS2液体必须浸没导气管口,目的是______________________。
②实验开始时打开K1,加热装置A、D,缓缓地向装置D中充入气体。装置A中的物质是___________(以化学式表示),装置C的作用可能是______________________。
(2)制备KSCN溶液:移去A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是_________________________________。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,___________,过滤,干燥,得到硫氰化钾晶体。
(4)测定KSCN的含量称取10.0g样品配成1000mL溶液量取20.00mL于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消AgNO3标准溶液20.00mL。
①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,则终点时的现象是___________。
②KSCN的质量分数为___________。
【答案】检查装置的气密性 使反应物充分接触,防止发生倒吸 NH4Cl、Ca(OH)2 观察气泡速率,控制加热温度 NH4SCN+KOH![]() KSCN+NH3+H2O 冷却结晶 当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 97.0%
KSCN+NH3+H2O 冷却结晶 当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 97.0%
【解析】
本题主要考察实验基本操作、陌生反应方程式的推断和书写、滴定的终点判断和相关计算。
(1)、①连接好装置后,实验前必须进行的一步操作是检查装置的气密性。根据相似相溶原理可知,氨气易溶于水、不易溶于二硫化碳,因此,为了使反应物充分接触,防止发生倒吸,所以三颈烧瓶的下层CS2液体必须浸没导气管口。
本题答案:检查装置的气密性;使反应物充分接触,防止发生倒吸
②制备 NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,反应需NH3,所以A装置为氨气发生器,实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。故装置A中的物质是NH4Cl , Ca(OH)2,装置C的作用可能是观察气泡速率,控制A装置的加热温度。
NH4SCN+H2S,反应需NH3,所以A装置为氨气发生器,实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。故装置A中的物质是NH4Cl , Ca(OH)2,装置C的作用可能是观察气泡速率,控制A装置的加热温度。
本题答案:NH4Cl , Ca(OH)2;观察气泡速率,控制加热温度
(2)、在装置C中发生反应得NH4SCN,装置D耐碱分液漏斗中装入的碱与NH4SCN发生反应生成硫氰化钾,故D中的反应化学方程式为NH4SCN+KOH![]() KSCN+NH3↑+H2O
KSCN+NH3↑+H2O
本题答案:NH4SCN+KOH![]() KSCN+NH3↑+H2O
KSCN+NH3↑+H2O
(3)、制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、冷却结晶、过滤、干燥,得到硫氰化钾晶体。
本题答案:冷却结晶
(4)、①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,以Fe(NO3)3为指示剂, SCN-与Fe3+反应使溶液呈血红色。当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复,即为终点。
本题答案:当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复
②20.00mL 0.1000mol/LAgNO3标准溶液滴定,c(Ag+)=0.1000mol/L╳0.02 L=0.002 mol,根据滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,可知20.00mL 中c(SCN-)= 0.002 mol,则1000mL 中c(SCN-)为0.1 mol,KSCN的质量分数=97.0g/ mol╳0.1 mol/10g╳ 100%=97.0%
本题答案:97.0%


科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
2Cl2(g)+2H2O(g) ΔH<0。下列有关说法不正确的是
A. 平衡前,随着反应的进行,容器内压强变小
B. 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小
C. 平衡时,其他条件不变,升高温度平衡常数增大
D. 其他条件不变,使用不同催化剂,HCl(g)的转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物 A 和 NaH 都是重要的还原剂,遇水都强烈反应。一定条件下,2.4g NaH 与气体 B 反应生成 3.9g 化合物 A 和 2.24L(已折算成标准状况)的 H2。已知气体 B 可使湿润红色石蕊试纸变蓝。请回答下列问题:
(1)B 的化学式是_____。
(2)NaH 与气体 B 反应生成化合物 A 的化学方程式_____。该反应中 A 是_____。
A.氧化产物 B.还原产物 C.既不是氧化产物也不是还原产物
(3)0.1molA 与足量盐酸发生非氧化还原反应最多消耗 HCl_____mol
(4)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,同时得到混合气体, 测得其平均摩尔质量为 25 g/mol,写出该反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是

A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
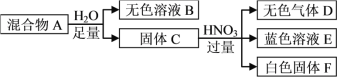
下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图,下列有关该电池的说法正确的是
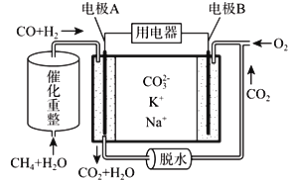
A. 反应CH4+H2O![]() 3H2+CO消耗1mol CH4转移4mol电子
3H2+CO消耗1mol CH4转移4mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大苏打(Na2S2O35H2O)、苏打和小苏打被称为苏打三兄弟,它们在生产生活中有广泛的应用。
(1)工业上,将碳酸钠和硫化钠以物质的量1:2混合配成溶液,再通入SO2可制取Na2S2O3,同时放出CO2,写出此反应的化学反应方程式___,硫化钠溶液在空气中久置会出现淡黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为:___。
(2)Na2S2O3标准溶液常用于滴定I2的含量,若滴定溶液呈酸性会导致测定结果偏高,用离子方程式解释其原因:____。
(3)工业上常用大苏打溶液吸收工业尾气中的Cl2,其氧化产物为SO42-,试写出其离子方程式:___,用下列一组试剂可以检测该反应是否已发生反应的有___。
A.AgNO3+HNO3(稀) B.BaCl2+HCl C.品红+H2SO4(稀) D.HCl+澄清石灰水
(4)在密闭容器中投入一定量的Na2O2和NaHCO3,300℃下充分反应,若残留固体为纯净物,则起始时n(NaHCO3)/n(Na2O2)必须满足的条件为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是 ( )
A. 分子中三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为:
C. 相同压强下,沸点:C3F8<C3H8
D. 全氟丙烷分子中既有极性键又有非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com