
【题目】有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,以下说法不正确的是
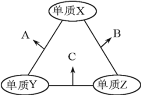
A.A和C不可能发生氧化还原反应
B.X元素位于ⅥA族
C.A不能溶解于B中
D.B的沸点高于C的沸点
【答案】A
【解析】
B和C均为10电子分子,考虑为氢化物,由原子半径由大到小的顺序为Y>X>Z可知,Z为氢,X、Y、Z原子序数之和为16,则X、Y的原子序数之和为15,则Y为碳元素、X为氟元素或者Y为氮元素、X为氧元素,由转化关系,单质X、Y反应生成A,单质Y、Z生成B,则Y应为氮元素、X应为氧元素,则A为NO、B为H2O、C为NH3,验证符合转化关系。
A.从N元素的化合价分析可知,NO和NH3可能发生归中反应,故能发生氧化还原反应![]() ,故A错误;
,故A错误;
B.氧元素位于第二周期ⅥA族,故B正确;
C.NO不能溶解于H2O,故NO可以用排水法收集,故C正确;
D.由于H2O的分子量比NH3的大,且水分子之间形成两个分子间氢键,而液氨中只能形成一个分子间氢键,故H2O沸点高于NH3的沸点,故D正确;
本题答案为:A


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:
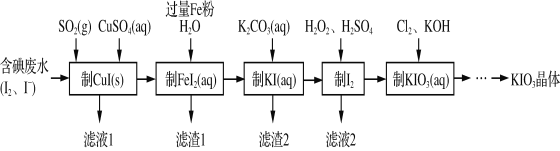
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。
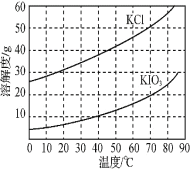
⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如图所示(部分反应条件略去):
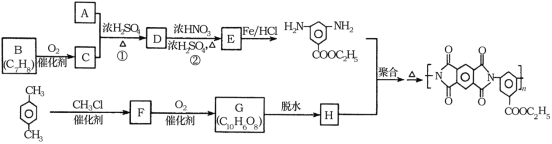
已知:①有机物A的质谱与核磁共振氢谱图如图所示:

②![]()
③
回答下列问题:
(1)A的名称是________________。
(2)反应②的反应类型是________________。
(3)反应①的化学方程式是________________。
(4)F的结构简式是________________。
(5)同时满足下列条件的G的同分异构体共有____种(不含立体结构);写出其中一种的结构简式:________________。
①能发生银镜反应
②发生发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备![]() 的合成路线:__________。
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.CH4 B.(CH3)2C=CH-CH3 C.C7H16 D.CH2 = CH—CH = CH2E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)1molE完全燃烧消耗氧气的物质的量____________________。
(3)A与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B在催化剂条件下发生加聚反应的化学方程式为 _________________________。
(5)C的同分异构体中含有三个支链的结构简式______________,其系统命名为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热, 在固体酸的催化下制备过氧乙酸(CH3COOOH),其装置如下图所示。请回答下列问题:
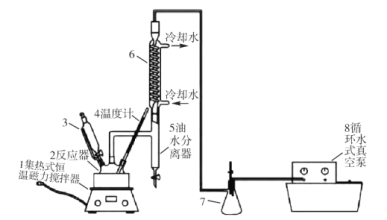
实验步骤:
I.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
II.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
Ⅲ.从仪器 5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
(1)仪器 6的名称是______,反应器 2中制备过氧乙酸(CH3COOOH)的化学反应方程式为_____。
(2)反应中维持冰醋酸过量,目的是提高_____;分离反应器 2中的混合物得到粗产品,分离的方法是_________。
(3)实验中加入乙酸丁酯的主要作用是_________(选填字母序号)。
A 作为反应溶剂,提高反应速率
B 与固体酸一同作为催化剂使用,提高反应速率
C 与水形成沸点更低的混合物,利于水的蒸发,提高产率
D 增大油水分离器 5的液体量,便于实验观察
(4)从仪器 5定期放出乙酸丁酯和水的混合物,待观察到___________(填现象)时,反应结束。
(5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品 VmL,分成 6等份,用过量 KI溶液与过氧化物作用,以 0.1mol L-1的硫代硫酸钠溶液滴定碘(I2+2S2O32-=2I-+S4O62-);重复 3次,平均消耗量为 V1mL。再以 0.02mol L-1的酸 性高锰酸钾溶液滴定样品,重复 3次,平均消耗量为 V2mL。则样品中的过氧乙酸的浓度为 ______mol L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图A),晶胞参数a=3.310A,b=4.380A。,c=10.500A。。黑磷烯是二维的单层黑磷(图B),黑磷烯与石墨烯结构相似,P的配位数为3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位 P,所有P原子的成键环境一样,图 A中编 号为①的 P原子的晶胞内坐标为(0.500,0.090,0.598)。请回答下列问题:
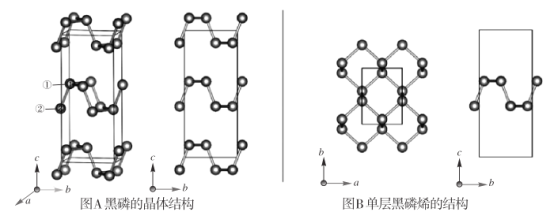
(1)写出基态P原子的价电子排布图:  __________。
__________。
(2)P和 F的电负性大小顺序是 x(P)______x(F)。(填 “<” “ =” 或 “ >” )P和 F形成的分子 PF3和PF5,它们的几何构型分别为__________、__________。
(3)①黑磷中 P原子杂化类型是__________。黑磷中不存在__________(选填字母序号)。
A 共价键 B σ键 C π键 D 范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为__________,原因是___________。
(4)图 A中编号为②的 P原子的晶胞内坐标为_______,黑磷的晶胞中含有________个 P原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1molN2与4molH2充分反应生成的NH3分子数为2NA
B.1molNa218O2与足量CO2完全反应时生成碳酸钠的质量为106g
C.标准状况下,22.4LCHCl3含有的C—Cl键数为3NA
D.18g18O2中含有的中子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )

A.反应的化学方程式为:X(g)+Y(g)Z(g)
B.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
C.反应开始到10s,X的物质的量浓度减少了0.79mol·L-1
D.反应开始到10s,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置制取溴苯,下列说法不正确的是( )
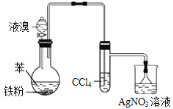
A. 该装置中CCl4的作用是除去产物HBr中混有的Br2蒸气
B. 若将液溴改为浓溴水,该反应也能进行
C. 通过AgNO3溶液中有淡黄色沉淀产生,说明由苯制溴苯的反应是取代反应
D. 该装置中左侧长导管的作用是导气兼冷凝回流
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com