
下列离子方程式正确的是()
A. 乙酸与碳酸钠溶液反应:2H++CO32﹣═CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO﹣+2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O 2C6H5OH+CO32﹣
2C6H5OH+CO32﹣
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH﹣ CO32﹣+2NH4++4Ag↓+6NH3+2H2O
CO32﹣+2NH4++4Ag↓+6NH3+2H2O
考点: 离子方程式的书写.
专题: 离子反应专题.
分析: A.乙酸是弱电解质应保留化学式;
B.醋酸溶液与新制氢氧化铜反应生成醋酸铜和水,注意醋酸和氢氧化铜都不能拆;
C.苯酚钠溶液中通入少量二氧化碳生成物为苯酚和碳酸氢钠,不符合反应的客观事实;
D.甲醛溶液与足量的银氨溶液共热发生银镜反应,注意1mol甲醛消耗4mol银氨络合物.
解答: 解:A.乙酸与碳酸钠溶液反应离子方程式:2CH3COOH+CO32﹣═CO2↑+2CH3COO﹣+H2O,故A错误;
B.醋酸溶液与新制氢氧化铜反应方程式:2CH3COOH+Cu(OH)2→Cu2++2CH3COO﹣+2H2O,故B正确;
C.苯酚钠溶液中通入少量二氧化碳离子方程式为:C6H5O﹣+CO2+H2O C6H5OH+HCO3﹣,故C错误;
C6H5OH+HCO3﹣,故C错误;
D.甲醛溶液与足量的银氨溶液共热离子方程式为:HCHO+4[Ag(NH3)2]++4OH﹣ CO32﹣+2NH4++4Ag↓+6NH3+2H2O,故D正确;
CO32﹣+2NH4++4Ag↓+6NH3+2H2O,故D正确;
故选:BD.
点评: 本题考查了离子方程式书写及正误判断,题目难度不大,易错选项C、D.注意苯酚钠和碳酸反应的实质、甲醛的结构特点是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列各组微粒中,都互为等电子体的是( )
|
| A. | CO、NO、NaH、N2 | B. | SO2、NO2+、N3﹣、OCN﹣ |
|
| C. | CO32﹣、NO3﹣、BCl3 | D. | SiF4、SiO44﹣、SO32﹣、PO43﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol
B. C2H2(g)+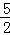 O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
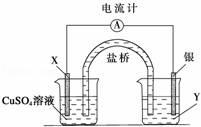
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极(填具体电极如Ag”).
查看答案和解析>>
科目:高中化学 来源: 题型:
聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示.下列有关说法不正确的是()
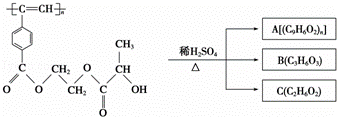
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
2003年“非典”曾在我国流行,民间都用过氧乙酸(CH3COOOH)作为消毒剂,因它具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢.有关过氧乙酸的叙述不正确的是()
A. 过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B. 过氧乙酸因具有强氧化性,所以有杀菌作用
C. 在使用过氧乙酸消毒时浓度不是越大越好
D. 过氧乙酸与苯酚混合使用杀菌能力更强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学与环境的叙述不正确的是()
A. 航天飞机上的隔离陶瓷属于复合材料
B. CO2和NO2是造成酸雨的主要原因
C. 燃煤中加入适量石灰石,可减少废气中SO2的含量
D. 垃圾是放错地方的资源,应分类回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
日常生活中使用的铝合金中的铝来自于电解氧化铝.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为Si02、Fe2O3、Ca0、Mg0、Na20等.工业生产铝锭的工艺流程示意图如下:
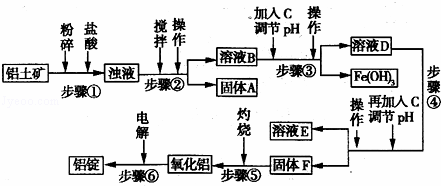
一些氢氧化物沉淀的pH如表:
沉淀物 Al(OH)3 Fe(OH)3 Mg(OH)2
开始沉淀pH(离子初始浓度为0.01mol/L) 4 2.3 10.4
完全沉淀pH(离子初始浓度为<10﹣5mol/L) 5.2 4.1 12.4
请回答下列问题:
(1)实验室进行步骤④的操作名称为 .
(2)固体A的化学式为 ,物质C的化学式为 .
(3)步骤④调节pH的范围为 .
(4)步骤⑥反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
国际无机化学命名委员会在1989年曾经建议,把长式周期表原先的主、副族及族号取消,从左到右改为第1~18列,第ⅠA族为第1列,稀有气体元素为第18列.按这个规定,下列说法不正确的是( )
|
| A. | 第15列元素的最高价氧化物为R2O5 |
|
| B. | 第2列元素中肯定没有非金属元素 |
|
| C. | 第17列元素的第一种元素无含氧酸 |
|
| D. | 第16、17列元素都是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com